
Datordesign (limegrön) jämförs med experimentella strukturer (lila) på atomnivå, avslöjar atomnoggrannhet i övergripande struktur (vänster) och i slingområden (höger). Kredit:Weizmann Institute of Science
Idén om proteiner som kan designas på datorer för specifika funktioner har varit ett banbrytande koncept som envist har legat kvar "i framtiden". Ny forskning vid Weizmann Institute of Science kan föra den framtiden lite närmare. Genom att gå tillbaka till naturens ritbord – evolutionen – har forskarna skapat nya proteiner, baserat på "befintliga naturliga delar, " som utför sin avsedda funktion med råge. Dessa fynd rapporterades i Proceedings of the National Academy of Sciences ( PNAS ).
Forskningen utfördes av Dr Sarel Fleishman och medlemmar av hans grupp vid institutionen för biomolekylära vetenskaper, inklusive forskarstudenterna Dror Baran, Maria Gabriele Pszolla, och Gideon Lapidoth. I Dr Fleishmans labb, proteiner är designade med datorbaserade program som gör det möjligt för dem att generera nya strukturer – t.ex. antikroppar eller enzymer – som inte finns i naturen. Om teamet vill ha ett protein som kommer att utföra en specifik åtgärd – säg, binder till ett annat protein eller utför en kemisk reaktion – de kan beräkna, från början till slut, den genetiska sekvensen som kommer att rada upp aminosyror i rätt ordning och få proteinet att vikas till den korrekta tredimensionella formen. Sådana proteiner kan i teorin, inleda en ny tid av specialdesignade läkemedel och katalysatorer, men utmaningarna med planering av stora biologiska molekyler är enorma.
Teamet ställde några enkla frågor:"Vad har ett naturligt enzym eller antikropp som de konstgjorda proteinerna inte har? Varför är två strukturer med liknande smink så olika när det kommer till hur de presterar i ett biologiskt system?"
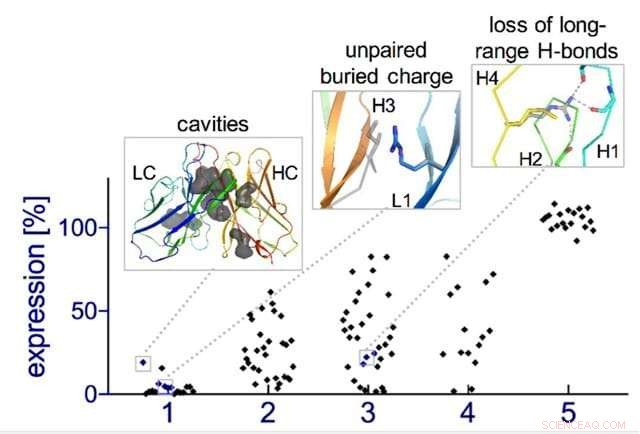
Lär dig reglerna för antikroppsdesign:Brister i designade insulininriktade antikroppar (insättningar) åtgärdas genom fem på varandra följande design-build-testrundor av algoritm "evolution, ”, vilket höjer andelen designade antikroppar som stabilt uttrycks av celler från nära 0 % till 100 %. Kredit:Weizmann Institute of Science
Gruppen fokuserade sin uppmärksamhet på vissa delar av naturliga antikroppar eller enzymer som börjar från början och inte kommer in i datordesignerna; särskilt, strukturer som kallas "slingor, " som till sin natur är instabila och "icke-idealiska" och, därför, utmanande när det kommer till beräkningsförutsägelse. Dessa "icke-ideala" loopar kan ofta hittas i mitten av de aktiva regionerna - de som känner igen ett mål eller binder till eller klyver en annan molekyl.
För att införliva dessa element, forskarna bestämde sig för att designa en fungerande antikropp från befintliga delar, istället för att bygga en från grunden. De bröt ner strukturerna som finns i naturliga antikroppar i segment, inklusive slingorna och andra stödjande funktioner. I själva verket, forskarna pysslade med färdiga delar, liknande hur evolutionen fungerar.
Naturlig evolution är, självklart, en mycket långsam process:En ny familj av antikroppar kan vara tiotals miljoner år på väg. Så forskarna gick tillbaka till den datoriserade planeringsprocessen, denna gång beväpnad med sin nya insikt. De nya designerna testades experimentellt i labbet, några dussin nya antikroppar åt gången. Initialt, designen fungerade dåligt, men genom fem design-bygg-testcykler, teamet upptäckte några allmänna regler för att designa antikroppar. I huvudsak, de skapade en sorts symbiotisk utveckling – designprogrammen utvecklades tillsammans med de experimentella testerna, var och en driver den andra framåt. För att demonstrera genomförbarheten av detta koncept, laget skapade artificiella antikroppar som riktade in sig på insulin, karakterisera dessa molekyler ner till upplösningen av enskilda atomer.
I framtida experiment, forskarna planerar att designa konstgjorda antikroppar som är modellerade på kameler och lamadjur. Varför just dessa djur? Om en mänsklig antikropp, eller en från valfritt antal vanliga djur, har 200 aminosyror, antikroppar i kameler och lamadjur består av bara 100 – och ändå stabila och effektiva. Detta skulle kunna göra design och produktion av artificiella antikroppar för mänskliga förhållanden mer effektiv, och kan ha relevans för att utforma ny diagnostik och terapi.