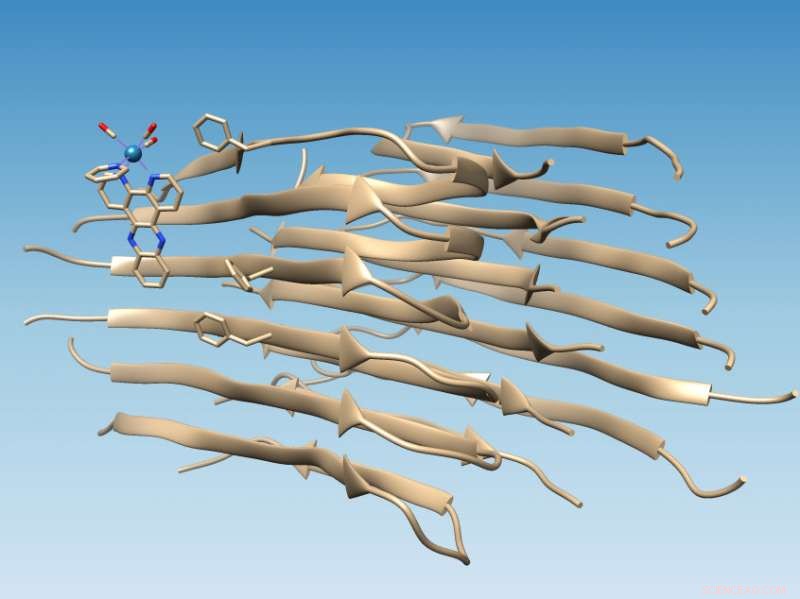
Ett rheniumbaserat komplex utvecklat vid Rice University binder till fibriller av felvikt amyloid beta-peptid, som markerar platsen för en hydrofob klyfta som kan fungera som ett läkemedelsmål, och oxiderar fibrillen, som ändrar dess kemi på ett sätt som skulle kunna förhindra ytterligare aggregering. Kredit:Martí Group/Rice University
En sond som uppfanns vid Rice University och som tänds när den binder till en felveckad amyloid beta-peptid – den typ som misstänks orsaka Alzheimers sjukdom – har identifierat ett specifikt bindningsställe på proteinet som kan underlätta bättre läkemedel för att behandla sjukdomen.
Ännu bättre, labbet har upptäckt att när den metalliska sonden är upplyst, det katalyserar oxidation av proteinet på ett sätt som de tror kan hindra det från att aggregeras i patienters hjärnor.
Studien som gjordes på långa amyloidfibriller backar upp datorsimuleringar av kollegor vid University of Miami som förutspådde att det fotoluminescerande metallkomplexet skulle fästa sig vid amyloidpeptiden nära en hydrofob (vattenundvikande) klyfta som visas på ytan av fibrilaggregatet. Den klyftan presenterar ett nytt mål för droger.
Att hitta platsen var relativt enkelt när labbet av riskemisten Angel Martí använde sina rheniumbaserade komplex för att rikta in sig på fibriller. Det ljusväxlande komplexet lyser när det träffas med ultraviolett ljus, men när den binder till fibrillen blir den mer än 100 gånger ljusare och orsakar oxidation av amyloidpeptiden.
"Det är som att gå på stranden, " Sa Marti. "Du kan se att någon var där före dig genom att titta på fotspår i sanden. Även om vi inte kan se rheniumkomplexet, vi kan hitta oxidationen (fotavtrycket) den producerar på amyloidpeptiden.
"Denna oxidationen sker bara bredvid den plats där den binder, " sade han. "Den verkliga betydelsen av denna forskning är att vi med hög grad av säkerhet kan se var molekyler kan interagera med amyloid betafibriller."
Studien visas i tidskriften Chem .
"Vi tror att denna hydrofoba klyfta är ett allmänt bindningsställe (på amyloid beta) för molekyler, " Sa Martí. "Detta är viktigt eftersom amyloid beta-aggregation har associerats med uppkomsten av Alzheimers sjukdom. Vi vet att fibrillär olöslig amyloid beta är giftigt för cellkulturer. Lösliga amyloidoligomerer som är gjorda av flera felveckade enheter av amyloid beta är också giftiga för celler, förmodligen ännu mer än fibrillär.
"Det finns ett intresse av att hitta mediciner som kommer att dämpa de skadliga effekterna av amyloid betaaggregat, " sa han. "Men för att skapa droger för dessa, vi måste först veta hur läkemedel eller molekyler i allmänhet kan binda och interagera med dessa fibriller, och detta var inte känt. Nu har vi en bättre uppfattning om vad molekylen behöver för att interagera med dessa fibriller."

En metallisk sond tänds när den binder till en felveckad amyloid beta-peptid i ett experiment vid Rice University. Sonden identifierade ett bindningsställe som skulle kunna underlätta bättre läkemedel för att behandla Alzheimers sjukdom. Kredit:Brandon Martin/Rice University
När amyloidpeptider viker sig ordentligt, de döljer sina hydrofoba rester samtidigt som de utsätter sina hydrofila (vattenattraherande) rester för vatten. Det gör proteinerna lösliga, sa Martí. Men när amyloid beta faller fel, det lämnar två hydrofoba rester, känd som Valine 18 och Phenylalanine 20, exponeras för att skapa den hydrofoba klyftan.
"Det är perfekt, för då drivs molekyler med hydrofoba domäner att binda dit, " Sa Martí. "De är kompatibla med denna hydrofoba klyfta och associerar med fibrillen, bildar en stark interaktion."
Om den resulterande oxidationen hindrar fibrillerna från att samlas längre in i det klibbiga ämne som finns i hjärnan hos Alzheimerspatienter, det kan vara början på en användbar strategi för att stoppa aggregation innan symtom på sjukdomen uppträder.
"Det är ett mycket attraktivt system eftersom det använder ljus, vilket är en billig resurs, " sa Martí. "Om vi kan modifiera komplex så att de absorberar rött ljus, som är genomskinlig för vävnad, vi kanske kan utföra dessa fotokemiska modifieringar i levande djur, och kanske en dag hos människor."

Från vänster, Rice University forskare Christopher Pennington, doktorand Bo Jiang och Angel Martí, en docent i kemi och bioteknik, köra ett amyloid beta-experiment i Martí-labbet. Kredit:Brandon Martin/Rice University
Han sa att ljusaktivering tillåter forskarna att ha "utsökt kontroll" av oxidation.
"Vi föreställer oss att det en dag kan vara möjligt att förhindra symtom på Alzheimers genom att rikta in sig på amyloid beta på samma sätt som vi behandlar kolesterol hos människor nu för att förhindra hjärt-kärlsjukdom, " sa Martí. "Det skulle vara underbart."