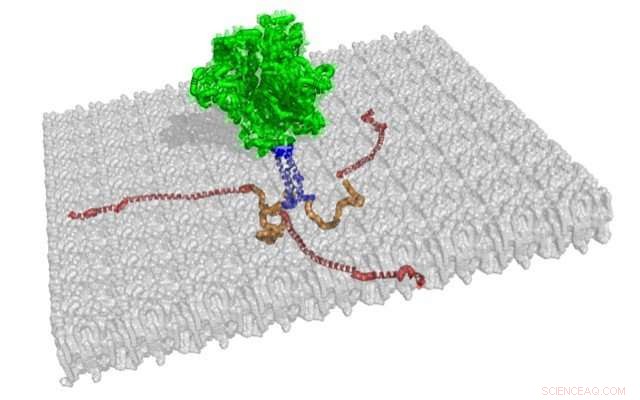
Strukturerna för tre membranassocierade cytoplasmatiska svansar av gp41 visas i rött och orange, från denna illustration av den trimeriska spetsstrukturen. Resten av detta HIV-1-höljeprotein, som är dockad på ett grått membran, är strukturerna för gp120 och gp41, visas i grönt, och transmembransegmentet, visas i blått. Kredit:Jamil Saad
Ett team från University of Alabama i Birmingham ledd av Jamil Saad, Ph.D., har löst den sista okända proteinstrukturen av HIV-1, retroviruset som kan orsaka AIDS.
Kunskap om denna struktur, kallas den cytoplasmatiska svansen av gp41-protein, kommer att hjälpa forskare att ytterligare förstå hur viruset infekterar mänskliga celler och hur avkommavirus sätts ihop och frigörs från infekterade celler. Den cytoplasmatiska svansen verkar spela en nyckelroll i virussammansättningen för att hjälpa till att införliva höljets spikstrukturer i ytan av viruspartiklar.
"Om vi kan hämma inkorporeringen av höljesproteinet, vi hämmar viral replikation, Saad sa. "Detta skulle avväpna viruset och förhindra sjukdom. Den cytoplasmatiska svansen är en kritisk komponent för smittsamhet."
Strukturen av den cytoplasmatiska svansen av gp41 var en oerhört svår uppgift att lösa, säger Saad, en docent i mikrobiologi vid UAB.
"Det var det mest utmanande projekt jag har stött på under de senaste 20 åren. Många gånger var jag på väg att sluta, men jag har en väldigt ihärdig labbgrupp."
Saad känner till många andra forskargrupper som inte kunde fastställa molekylstrukturen.
Ett problem för Saad och hans UAB-kollegor kom när de försökte uttrycka den cytoplasmatiska svansen av gp41 i växande E. coli-celler. Istället för intakt produkt, ett bakteriellt enzym skar proteinet under proteinuttryck. "Vi har aldrig sett detta för något annat protein, " sa Saad. Forskarna fann att de var tvungna att begränsa proteinuttrycket till bara två timmar. Även då, 70 procent av den cytoplasmatiska svansen skars och endast 30 procent lämnades intakt.
Det tog över två år och ansträngningar med 100 olika förutsättningar för att få en bra produkt, säger Saad. "Nu kan vi klara det på två dagar."
Snittet visade sig vara användbart. En bit var löslig, och Saad-gruppen kunde undersöka dess struktur med hjälp av kärnmagnetisk resonans, eller NMR. Den andra biten var olöslig, så forskarna var tvungna att använda en lösning av miceller - dispergerade lipider eller tvättmedelsliknande aggregat i en lösning - för att låta den olösliga biten bilda sin struktur i en membranliknande miljö. Liksom tillväxtförhållandena, forskarna behövde många försök för att hitta korrekta membranförhållanden. En micelllösning påminner lite om vinäger och olja efter att man har skakat det hårt för att sprida små oljedroppar genom hela dressingen.
På nytt, NMR användes för att lösa den olösliga strukturen medan den inkorporerades i miceller.
När Saad-gruppen satte molekyler av den intakta, fullängds cytoplasmatisk svans av gp41 in i micelllösningen, de fann att strukturerna för var och en av delarna bibehölls i den intakta strukturen.
De fann att den N-terminala änden av den cytoplasmatiska svansen av gp41, mäter 45 aminosyrarester, saknade en regelbunden sekundär struktur och var inte associerad med membranet, som sveper runt en HIV-1-viruspartikel som läderöverdraget på en baseboll. Den C-terminala änden av den cytoplasmatiska svansen av gp41, mäter 105 aminosyrarester, var tätt associerad med membranet och hade tre alfa-helixar med delar som var hydrofoba och delar som var hydrofila. UAB-gruppen visade också den föredragna topologin för den cytoplasmatiska svansen när den var bunden till membranet.
Saad säger att strukturen öppnar upp helt nya forskningsområden:Hur den cytoplasmatiska svansen stabiliserar höljesproteinstrukturen, hur det påverkar membranrörligheten i höljesproteinstrukturen, och hur det hjälper till att koordinera membranbindning och associeringen av 2, 000 HIV-1 Gag polyproteiner under membranytan. Gag-polyproteinerna skärs senare inuti det mogna viruset för att bilda flera mindre matriser, kapsid- och nukleokapsidproteiner som producerar den kondenserade virala kärnan.
Saad säger att kunskap om den cytoplasmatiska svansstrukturen gp41 också kommer att öppna jämförande studier av 10 olika retrovirus som har liknande svansar för att lära sig varför vissa svansar är kortare och vissa svansar är längre.
"Den cytoplasmatiska svansen av gp41 har varit av intresse under lång tid, och ingen förstår hur det fungerar vid infektion eller hur det hjälper till att införliva höljesproteinet i membranet, sa Saad.