Den här grafiken visar hur en ny teknik utvecklats vid Purdue University som simulerar tumörer. Kredit:Purdue University foto/Altug Ozcelikkale
En ny teknik som simulerar tumörer har visat sig fungera lika bra som att forska djur i att testa kemoterapiläkemedel, representerar ett potentiellt verktyg för att screena läkemedel innan man behandlar en patient.
Ett långsiktigt mål är att inkorporera biopsierade cancerceller från patienter och testa effektiviteten av olika läkemedel på de patienthärledda cellerna, sa Bumsoo Han, en Purdue University professor i mekanisk och biomedicinsk teknik.
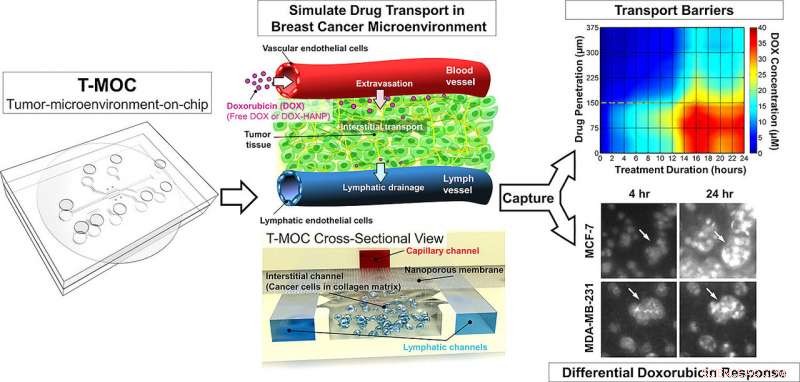
"Det finns många olika typer av kemoterapiläkemedel, så att läkare kanske kan begränsa vilka som sannolikt är mer effektiva än andra, ” sade han. ”Framgångsrik läkemedelsleverans och att övervinna läkemedelsresistens är de primära kliniska utmaningarna för hantering och behandling av cancer. För att lösa detta problem, vi utvecklade tumör-mikromiljö-på-chipet (T-MOC)."
Enheten är cirka 4,5 centimeter (1,8 tum) kvadratisk och innehåller "mikrofluidiska" kanaler där cancerceller odlas i en tredimensionell "extracellulär matris, " ett ställningsliknande material som finns mellan celler i levande vävnad. Experimenten innehåller också "interstitiell vätska, " som finns inuti tumörer och tros vara ett hinder för läkemedelstillförsel.
Ett sådant verktyg skulle kunna användas för "precisionsmedicin, " där läkemedelsbehandling är skräddarsydd för individuella patienter och vissa cancertyper. Läkemedelsresistens och olika subtyper av tumörer representerar kritiska flaskhalsar för effektiv kemoterapi. Cancerceller producerar multiresistenta proteiner som pumpar ut cancerläkemedlen ur cellerna, hjälpa dem att överleva cytostatikabehandling.
Forskningen syftar till att utveckla en plattform för läkemedelsscreening för att efterlikna dessa multipelläkemedelsresistensmekanismer, samt att validera resultaten mot den nuvarande guldstandarden, forskning med små djur, sa Han.
Nya forskningsrön beskrevs i ett papper som ska publiceras i november i Journal of Controlled Release . Uppsatsens huvudförfattare är Purdue postdoktoral forskarassistent Altug Ozcelikkale.
Forskarna använde det vanliga kemoterapiläkemedlet doxorubicin och testade även skillnaden mellan doxorubicin i konventionell form jämfört med en nanopartikelläkemedelsleveransformulering.
Uppsatsen var medförfattare av forskare knutna till Purdues School of Mechanical Engineering, Institutionen för jämförande patobiologi, Centrum för cancerforskning, Weldon School of Biomedical Engineering och Birck Nanotechnology Center; Indiana Universitys avdelning för farmakologi och toxikologi; och det biomedicinska forskningsinstitutet vid Korea Institute of Science and Technology. En lista över medförfattare ingår i abstraktet.
Forskarna har tidigare visat att T-MOC-enheten kunde särskilja olika typer av cancerceller. I de nya rönen, teamet visade att T-MOC presterade lika bra som forskar möss i att testa effektiviteten av läkemedel mot cancer på två typer av bröstcancerceller, kallas MCF-7 och MDA-MB-231. Dessutom, den molekylära mekanismen för doxorubicinresistens överensstämde med den hos möss, sa Han.
Fynden visade också att T-MOC kan simulera "plasmaclearance, "ett kroppssvar där läkemedel mot cancer filtreras av levern och njurarna, tillåter endast en liten mängd att nå tumören.
Båda cellinjerna odlade på T-MOC visade ökad resistens mot läkemedlen jämfört med celler odlade på en vanlig platt petriskålkultur, matcha resultaten med möss och föreslå ett mer verklighetstroget resultat.
"Detta bekräftar T-MOC:s prediktiva förmåga för läkemedelssvar in vivo, Han sa. "Denna initiala karaktärisering av T-MOC indikerar dess transformativa potential för att testa läkemedelseffektivitet."
Framtida arbete kommer att utöka forskningen om olika cancertyper inklusive pankreascancer och prostatacancer.