
Bilder på F420H2-oxidaskristaller erhållna aerobt med en typisk storlek på 0,1 mm. Med syre ger Fe och flavin inuti enzymet den naturliga gula färgen till kristallerna. Kredit:Max Planck Institutet för marin mikrobiologi/T. Wagner
Metan är en kraftfull växthusgas som spelar en central roll i den globala kolcykeln. På samma gång, det är en viktig energikälla för oss människor. Ungefär hälften av dess årliga produktion görs av mikroorganismer som kallas metanogener som bryter ner organiskt material som döda växter. Detta sker normalt i en livsmiljö utan syre eftersom denna gas är dödlig för metanogener. Men även i faktiskt syrefria livsmiljöer, syremolekyler dyker upp ibland. För att göra dessa inkräktare ofarliga, metanogener har ett speciellt enzym som kan omvandla syre till vatten.
"Enzymer är viktiga komponenter i metabolismen av alla levande organismer och målet för vårt laboratorium är att förstå hur dessa nanomaskiner fungerar på molekylär nivå, " säger Tristan Wagner från Max Planck Institute for Marine Microbiology och första författare till studien, publicerad i den vetenskapliga tidskriften Kemisk kommunikation i september 2020. För studien, Wagner odlade anaerob mikroorganism som kallas Methanothermococus thermolithotrophicus, som härrörde från sedimentet i Neapelbukten. Han renade enzymet F420-oxidas, ett flavodiiron-protein, och kristalliserade det, en vanlig metod för att studera enzymers funktion.
"Det var redan känt att F420-oxidas kan omvandla syre till vatten, " säger Wagner. "Men vi lyckades dekryptera mekanismen." Studien är ett samarbete mellan forskare från Max Planck Institute for Marine Microbiology, Max Planck Institute for Terrestrial Microbiology, Paul Scherrer Institute, Interdisciplinary Research Institute of Grenoble och European Synchrotron Radiation Facility.
Syre är inlåst
Mekanismen, forskarna avslöjade, har ett viktigt krav:syre är mycket reaktivt, så det är avgörande att reaktionen kontrolleras korrekt av enzymet och att inga lösningsmedel flyter runt. Annars kan syret av misstag omvandlas till superoxid och döda den anaeroba. Tricket med enzymet F420-oxidas är att använda en gaskanal och ett grindsystem. Syremolekylen leds först i den specifika kanalen till en lämplig vattenfri katalytisk hålighet som innehåller järn. Sedan omvandlar järn syret i vatten som kommer att frigöras av en grindmekanism. För att hålrummet börjar röra sig och öppnar en liten "dörr". Tack vare rörelsen, det nyproducerade vattnet transporteras utanför. Den tomma håligheten stängs igen och är tillgänglig för nästa syremolekyl.
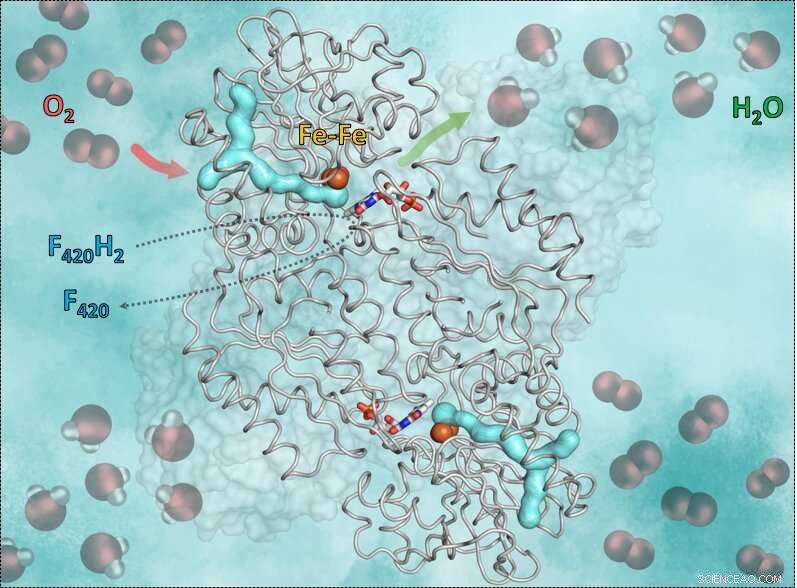
Den här bilden visar enzymet F420H2-Oxidas och hur det fungerar. Den cyan y-formade delen är gaskanalen. Den röda pilen visar vägen in av syret till den katalytiska kaviteten som innehåller järn. Den gröna pilen symboliserar vägen ut ur vattnet. Än, de blåröda stickorna i mitten visar flavinet (FMN) som tar emot elektroner från det reducerade koenzymet F420, som ger det väte som behövs för att omvandla syret till vatten. Kredit:S. Engilberge och T. Wagner
För att få insikter i denna mekanism använde forskarna röntgenkristallografi. De fick först kristallstrukturen utan syre, där de kunde se den vattenfria katalytiska kaviteten isolerad från lösningsmedlet. Sedan, de gasade enzymkristallerna med den inerta gasen krypton, som, till skillnad från syre, kan göras synlig med röntgenstrålar. Efteråt bestrålade de enzymkristallerna och kunde detektera kryptonatomer som visade gaskanalen som leder till den katalytiska kaviteten. Flavodiironproteinet och dess kanal bevaras inte bara i metanogener, men också i andra mikroorganismer som clostridia (som huvudsakligen lever i jord eller i matsmältningskanalen), hos svavelbakterien Desulfovibrio gigas eller till och med hos tarmparasiten Giardia intestinalis.
Ju snabbare desto bättre
"Den här reaktionen är väldigt snabb, " säger Sylvain Engilberge från Paul Scherrer Institute och första författare till studien bredvid Tristan Wagner. "Denna hastighet är också den stora betydelsen av vår undersökning." Liknande enzymer som laccas är mycket långsammare. "För framtida tillämpning av bioinspirerad elektrokemisk processer, vi måste lära oss mer av den kemiska reaktionen, struktur och funktion hos olika grupper av syrereducerande enzymer, " säger Engilberge. Det skulle också bana väg för proteinteknik att omvandla en höghastighets O2-detoxifierare till en elektronsänka för industriella processer.
"Vårt nästa steg skulle vara att förstå mångfalden av flavodiiron-protein, " säger Tristan Wagner. Vissa homologer är inte inriktade på syre utan den giftiga kväveoxiden, deras enzymer kan skilja mellan båda gaserna med hög specificitet. Men vad är det selektiva filtret? Gaskanalen? Miljön i den katalytiska kaviteten? "Fler studier måste utföras för att förstå hur proteinet särskiljer syre och kväveoxid, " tillägger Wagner. Med sådan kunskap, det skulle till exempel vara möjligt att förutsäga från genomisk information om ett flavodijärnprotein skulle vara ett syre- eller kväveoxidfångare.