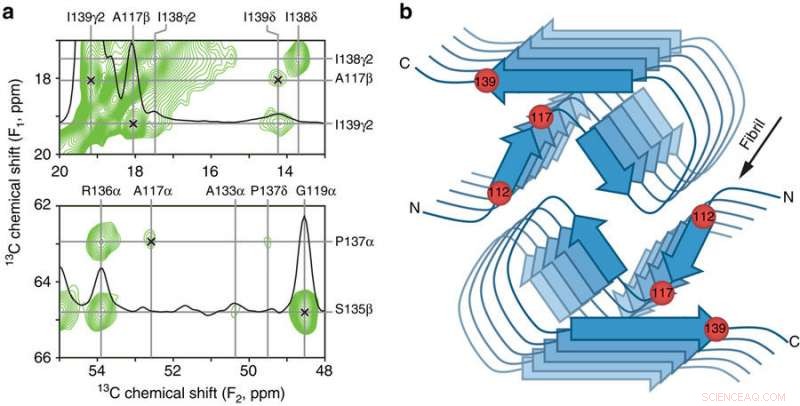
Nyckelkontakter och schematisk modell av den mänskliga PrP23-144 amyloid β-kärnan. a Små regioner av ett 900 MHz tvådimensionellt 13C–13C DARR-solid-state NMR-spektrum registrerat med en blandningstid på 500 ms för amyloidfibriller genererade från huPrP23-144 uttryckt med 3-13C-pyruvat som kolkälla. Spektralregionerna innehåller nyckelbegränsningarna på [hu] amyloidkärnstrukturen i form av otvetydiga långdistanskorrelationer (indikerade med x-märken) mellan följande 13C-atomer:A117Cβ-I139Cγ2, A117Cβ-I139Cδ, A117Cα-P137Cα, och G119Ca-S135Cp. b Schematisk modell för [hu] amyloidkärnan baserad på kombinationen av solid-state NMR och data från transmissionselektronmikroskopi med lutande strålar (se text för detaljer). I denna modell består [hu] amyloidfibriller av två protofilament i ett C2-symmetriskt arrangemang med β-arkregioner som löper parallellt med den långa fibrillaxeln. De ungefärliga placeringarna av aminosyraresterna 112, 117, och 139, som har stor inverkan på strukturen antagen av PrP23-144 amyloid som diskuteras i texten, indikeras med röda sfärer. Kreditera: Naturkommunikation (2017). DOI:10.1038/s41467-017-00794-z
Forskare som studerar ett protein som orsakar en ärftlig degenerativ hjärnsjukdom hos människor har upptäckt att människan, mus- och hamsterformer av proteinet, som har nästan identiska aminosyrasekvenser, uppvisa distinkta tredimensionella strukturer på atomnivå.
Proteinet orsakar familjär human cerebral amyloidangiopati (CAA), och studien, som dyker upp i Naturkommunikation , är den första att undersöka former av proteinet i tre olika arter.
Christopher Jaroniec, professor i kemi och biokemi vid Ohio State University, sade att resultaten belyser det faktum att mindre förändringar i enstaka aminosyror kan orsaka djupgående skillnader i struktur och funktion bland denna familj av proteiner.
"De storskaliga skillnaderna i strukturerna och transmissionsegenskaperna hos dessa proteiner - orsakade av vad som uppgår till till synes obetydliga skillnader i positionerna för ett fåtal kol- och väteatomer - är ganska anmärkningsvärda, "Sa Jaroniec.
Studien ligger inte till grund för ett nytt test eller behandling för CAA, utan använder snarare dessa proteiner som modeller för att förstå de grundläggande aspekterna av överföring mellan arter av en hel klass av degenerativa hjärnsjukdomar som kallas prionsjukdomar, han förklarade. Det understryker också användbarheten av solid-state nuclear magnetic resonance (NMR) spektroskopi för att avbilda strukturerna hos proteiner associerade med prionsjukdomar.
Forskare vet att i kroppen, proteinmolekylerna associerade med CAA bildar plack som ligger i blodkärlens väggar i hjärnan, men det har inte gjorts detaljerade undersökningar av den molekylära strukturen hos dessa plack förrän nyligen. 2008, Ohio State forskare och deras partners vid Case Western Reserve University utförde de första solid-state studierna av den relevanta prionproteinvarianten, och minskade listan över möjligen kritiska aminosyror för dess funktion till cirka 30.
Nu, de har visat att en enda aminosyra – känd genom sitt antal längs proteinkedjan, 139 - är nyckeln till att denna prionproteinvariant antar en "mänsklig" kontra en "hamsterliknande" struktur, medan en annan aminosyra, 112, styr de strukturella skillnaderna mellan mänskliga och musversioner av proteinet. De har också visat att dessa två aminosyror verkar vara ansvariga för uppkomsten av strukturellt distinkta "prionstammar" inom samma proteinsekvens, i analogi med distinkta stammar av ett virus.
De mest kända prionsjukdomarna inkluderar bovin spongiform encefalopati (ofta kallad "galna ko-sjukan") och Creutzfeldt-Jakobs sjukdom hos människor. Alla är obotliga och dödliga, och vissa kan också överföras. De strukturer som antagits av hjärnprionproteinerna inom placken anses vara kritiska för deras förmåga att överföras mellan olika värdar och orsaka sjukdom.
"Vår grupp arbetar för närvarande med att bestämma de högupplösta molekylära strukturerna för de trunkerade prionproteinvarianterna associerade med familjär human CAA för att få en fullständig atomistisk förståelse av de faktorer som ligger bakom deras överföring, och föreliggande studie är en viktig språngbräda i detta arbete, " sa Jaroniec.
"Vi hoppas att vår grupp och andra forskare en dag kommer att kunna använda liknande metoder för att reda ut den strukturella grunden för de överförbara prionsjukdomarna, " han lade till.