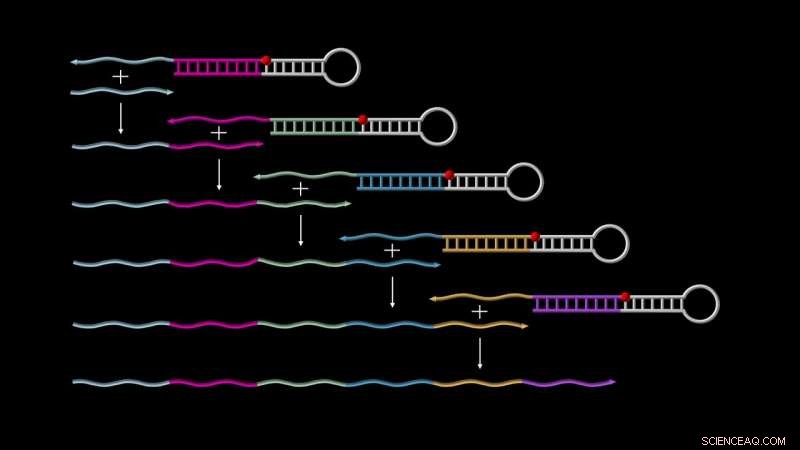
Primer Exchange Reaction (PER)-kaskader möjliggör autonom tillväxt av enkelsträngade DNA. På toppen, en 'katalytisk PER-hårnål' binder en första 'primer' (visas som en kort grå tråd), utlöser dess förlängning med en sekvens kodad av själva hårnålen, och släpper den för att starta en ny cykel med den redan utökade primern, och så vidare, tills en lång transkription genereras. Kredit:Wyss Institute vid Harvard University
Syntetiska biologer och nanobiologer omarbetar DNA, det ärftliga materialet som finns i nästan alla kroppens celler, som ett smart och stabilt självmonterande material för att bygga nanofabriker, läkemedelslevererande nanostrukturer och molekylära enheter som kan känna av sin miljö och reagera på olika sätt genom, till exempel, upptäcka inflammation i kroppen eller gifter i miljön. Dessa applikationer i nanoskala involverar ofta syntes av stora sekvenser som omfattar tusentals av de byggstenar som DNA är gjort av, känd som A, T, C och G nukleotidbaser, som kan vikas och struktureras ytterligare på grund av den specifika basparningsförmågan mellan As och Ts, och Cs och Gs, respektive.
Dock, än så länge, Forskare har inte verktyg till sitt förfogande som skulle tillåta större enkelsträngade sekvenser att växa autonomt och sedan sammanfoga varandra från ände till ände enligt en molekylär designplan, en förmåga som skulle kunna generera strukturer och enheter med olika möjligheter.
Publicerad idag i Naturkemi , forskning av Peng Yin vid Harvards Wyss Institute for Biologically Inspired Engineering ger en brett användbar lösning på detta problem. Yin och hans team har utvecklat en metod som gör att fördesignade DNA-sekvenser autonomt kan växa och sammanfoga längs specifika monteringsvägar, vilket ger grunden för en ny generation programmerbara molekylära enheter. Genom att testa deras nya koncept med så kallade 'Primer Exchange Reaction' (PER) kaskader, de konstruerade framgångsrikt en första uppsättning enheter med olika funktioner, såsom självbyggande DNA-origami och DNA-nanostrukturer som känner, förstärka, registrera eller logiskt utvärdera miljösignaler.
Tidigare metoder producerade identiska kopior av en fast mindre sekvens, men de kan inte lägga till olika syntetiserade sekvenser till varandra i definierade mönster för att generera större sammansättningar autonomt utan användarmedierad intervention. "De autonoma och programmerbara funktionerna som PER-kaskader erbjuder kan skapa en helt ny generation av programmerbara molekylära enheter och applikationer och täppa till luckor i designarbetet, för vilka många rörliga delar redan finns, " sa Wyss Institute Core Faculty-medlem Peng Yin, Ph.D., som ledde studien och är även professor i systembiologi vid Harvard Medical School (HMS). "Vi tillhandahåller proof-of-concept-data för PER i en mängd olika toppmoderna syntetiska biologiska applikationer som tydligt belyser teknikens breda potential."
Wyss Institutes team använde det nya konceptet för att designa en serie sådana PER DNA-transkript för mycket olika tillämpningar, inklusive den autonoma syntesen av stora DNA-nanostrukturer kända som DNA-origamis, och syntetbiologiska tillvägagångssätt, där syntesen av ett DNA-transkript beror på en trigger, såsom ett cancerassocierat litet mikro-RNA. Deras PER-metod kan till och med generera DNA-transkript som är resultatet av en logiskt utvärderad kombination av olika triggers, liknande RNA Ribocomputing Devices som Yins team publicerade tidigare i år. Intressant, PER -DNA -transkript kan själva bli katalytiska, att kunna skära ett godtyckligt mål-RNA, blir fluorescensmärkta prober som förstärker närvaron av en viss molekylär stimulans, eller "molekylära registrerare" som troget indikerar i vilken ordning vissa molekylära signaler uppträder i deras miljöer.
För att starta PER-kaskaden, två grundläggande komponenter behövs. Den ena kallas en "katalytisk DNA-hårnålsförmedlare", som är en enkelsträngad DNA-molekyl som delvis kopplas ihop med sig själv för att bilda en hårnålsstruktur med en kort överhängande enkelsträng. Detta överhäng är designat för att fånga PER-kaskadernas andra komponent, "primern, " som innehåller en region som är komplementär till överhänget. Genom en serie förlängnings- och förskjutningsreaktioner, primern förlängs med en sekvens som tillhandahålls av den katalytiska hårnålsmediatorn och drivs sedan ut. Detta frigör den katalytiska hårnålsförmedlaren för att kaskadera nästa omgång av processen, antingen genom att fånga en ny startprimer eller den redan långsträckta primern – och så vidare.
Dessa komplexa syntesvägar fortskrider autonomt, jämförbar med en molekylär robot som utför en given uppgift, och vid en enda temperatur, vilket gör tekniken mycket robust. "Tillvägagångssättet ger oss en enorm kreativ frihet:vi kan inte bara syntetisera samma DNA -bit om och om igen som nya tillägg av en växande sekvens, men vi kan också variera typerna av DNA-sekvenser som ska läggas till helt enkelt genom att ändra sammansättningen av katalytiska hårnåls-DNA och primers i blandningen medan monteringen pågår. Detta gör att vi kan få syntesen att förgrena sig i olika riktningar och att intrikat mönstra sammansättningen av det slutliga DNA-transkriptet, " sa studiens första författare Jocelyn Kishi, som som National Science Foundation (NSF) forskarassistent vid HMS arbetar på Yins Wyss Institute -team. "Vi arbetar nu mot att implementera PER-kaskader för en mängd olika applikationer, inklusive molekylära registreringsenheter, sofistikerad diagnostik, och vävnadsavbildning. Vi hoppas också att dessa system en dag kan användas i levande celler som enheter som kan spela in händelser eller omprogrammera cellbeteende på specifika sätt, sa Kishi.
"Detta nya framsteg som visar hur DNA-molekyler kan programmeras för att själva montera ihop till specifika 3D-strukturer och utföra fördefinierade funktioner och uppgifter representerar ett stort steg framåt inom området Molecular Robotics, och ger en inblick i framtiden för enheter för både medicinska och icke-medicinska applikationer, " sa Wyss Institutes grundare Donald Ingber, M.D., Ph.D., som också är Judah Folkman professor i vaskulär biologi vid HMS och Vascular Biology Program vid Boston Children's Hospital, samt professor i bioteknik vid Harvard John A. Paulson School of Engineering and Applied Sciences (SEAS).