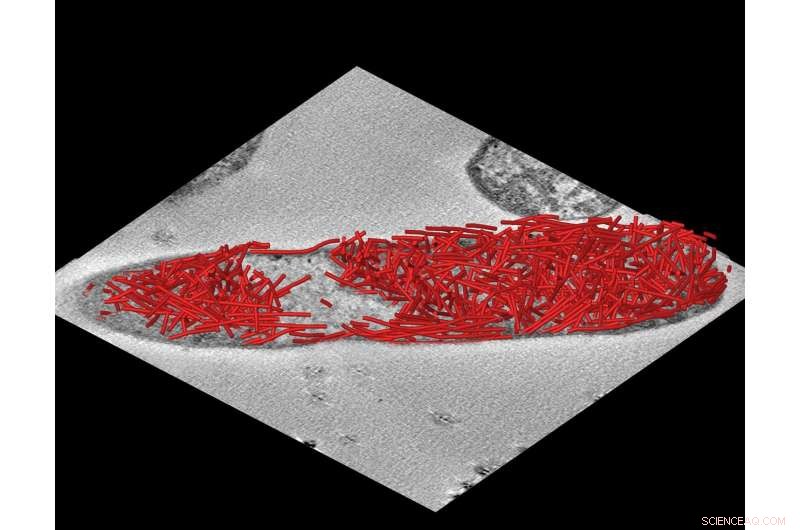
Grafisk bild av rörformiga ställningar i celler. Kredit:University of Kent
Forskare vid universiteten i Kent och Bristol har byggt en miniatyrställning inuti bakterier som kan användas för att stärka cellulär produktivitet, med konsekvenser för nästa generations biobränsleproduktion.
Eftersom det finns ett växande behov av jordbruks- eller förnybar produktion av biobränslen och andra råvarukemikalier för att flytta bort från fossila bränslen, forskare har länge försökt att förbättra den interna organisationen av bakterier och förbättra effektiviteten hos cellerna för att tillverka näringsämnen, läkemedel och kemikalier.
Forskargruppen, ledd av professor Martin Warren vid Kent's School of Biosciences, arbetar med professorerna Dek Woolfson och Paul Verkade i Bristol, fann att de kunde göra nanorör som genererade en byggnadsställning inuti bakterier.
Med så många som tusen rör som passar in i varje cell, den rörformiga ställningen kan användas för att öka bakteriernas effektivitet när det gäller att tillverka råvaror och utgöra grunden för en ny era av cellulär proteinteknik.
Forskarna utformade proteinmolekyler och utvecklade tekniker för att tillåta E. coli att göra långa rör som innehåller en kopplingsanordning till vilken andra specifika komponenter kan fästas. En produktionslinje av enzymer kunde sedan anordnas längs rören, skapa effektiva interna fabriker för samordnad produktion av viktiga kemikalier.
Utiliserar en form av molekylär kardborre för att hålla komponenterna ihop, teamet lade till en del av fästelementet till det rörbildande proteinet och den andra till specifika enzymer för att visa att enzymerna kan fästa vid rören.
Genom att tillämpa denna nya teknik på enzymer som krävs för produktion av etanol – ett viktigt biobränsle – kunde forskarna öka alkoholproduktionen med över 200 %.
Detta forskningsråd för bioteknik och biologiska vetenskaper (BBSRC) finansierade samarbetsprojekt mellan University of Kent, University College London och University of Bristol med titeln Engineered synthetic scaffolds for organizing proteins in the bakteriell cytoplasm publiceras nu i tidskriften Naturens kemiska biologi .