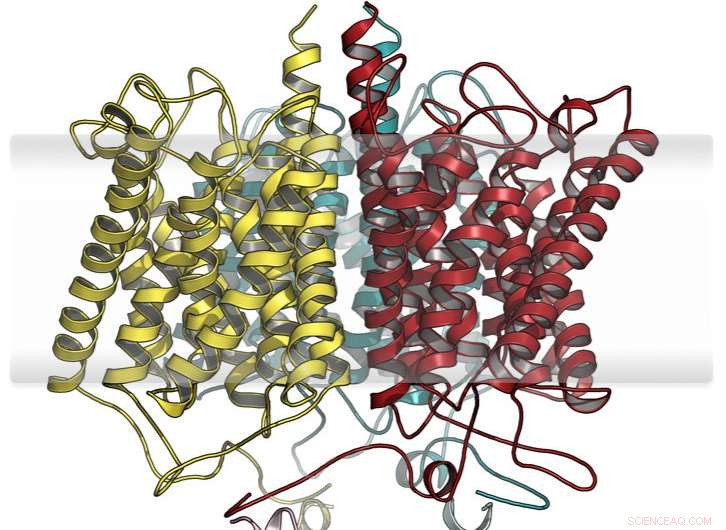
Hypotetisk utökad modell av anammox ammoniumsensorprotein. Kredit:Susana Andrade
Ett team under ledning av Freiburgs biokemist Prof. Dr. Susana Andrade har karakteriserat ett protein som gör det möjligt för vissa mikroorganismer att känna igen och absorbera ammonium i sin miljö. Ammonium anses vara ett toxin som förorenar ekosystemen - men för dessa bakterier utgör det en viktig närings- och energikälla. Forskarna har publicerat sina resultat i den vetenskapliga tidskriften Naturkommunikation .
Grundämnet kväve är en oumbärlig byggsten i alla biomolekyler och därför av stor betydelse för alla organismer. Dessutom, vissa medlemmar av det mikrobiella samhället har specialiserat sig på att använda olika kväveföreningar som energikälla för optimal tillväxt. Detta är särskilt fallet bland anaeroba ammoniumoxidationsmedel:Dessa bakterier behöver inte syre för sin ämnesomsättning utan istället, omvandla två viktiga kväveföreningar, ammonium och nitrit, till kvävgas, som står för cirka 80 procent av jordens atmosfär. Genom denna reaktion, dessa mikroorganismer spelar en viktig roll i avgiftningen av kväveföreningar som i allt högre grad släpps ut i miljön genom användning av konstgödsel.
Andrade och hennes team från fakulteten för kemi och farmaci vid universitetet i Freiburg har identifierat ett ovanligt protein i sådana bakterier:Hälften av det liknar kända transportproteiner för ammoniumjoner och den andra hälften tillhör en grupp av signaltransducerande proteiner. Detta ledde till misstanken att två byggstenar, redan finns i naturen, hade kombinerats på ett modulärt sätt för att möjliggöra en helt ny funktionalitet:detektering av ammonium från omgivningen och efterföljande överföring av denna information till de cellulära signalnäten.
Forskarna genomförde en omfattande funktionell och strukturell karakterisering av detta nya protein, som också involverade arbetsgrupper från University Medical Center Freiburg; Radboud University i Nijmegen, Nederländerna; ryska vetenskapsakademin; och European Molecular Biology Laboratory (EMBL) i Hamburg. Som ett resultat, det ursprungliga antagandet bekräftades:Baserat på ett mycket selektivt ammoniumtransportprotein, evolutionen har gett upphov till en ny igenkänningsplats för jonerna, vars sysselsättning leder till konformationsförändringar som förs vidare till den signaltransducerande modulen. Denna direkta modulära koppling erbjuder möjligheten att smälta andra signaltransduktionsenheter till ammoniumsensormodulen för att konstruera nya cellulära funktioner.