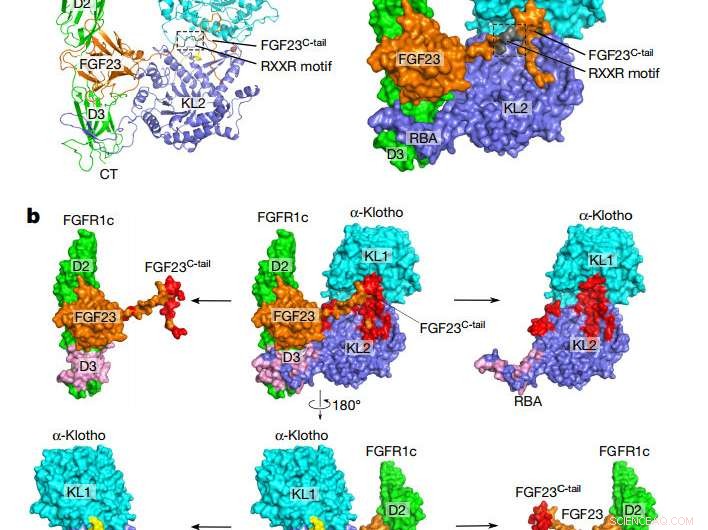
Övergripande topologi för FGF23–FGFR1cecto–α-klothoecto-komplexet. a, Tecknad (vänster) och ytrepresentation (höger) av den ternära komplexa strukturen. α-klotho KL1 (cyan) och KL2 (blå) domänerna är förenade av en kort prolinrik linker (gul; inte synlig i ytpresentationen). FGF23 är i orange med sitt proteolytiska klyvningsmotiv i grått. FGFR1c är grönt. CT, C-terminal; NT, N-terminal. b, Bindande gränssnitt mellan α-klothoecto och FGF23–FGFR1cecto-komplexet. Det ternära komplexet (mitten) visas i två olika orienteringar relaterade till en 180° rotation längs den vertikala axeln. FGF23–α-klothoecto (röd) och FGFR1cecto– α-klothoecto (rosa) gränssnitt visualiseras genom att dra α-klothoecto och FGF23–FGFR1cecto-komplexet bort från varandra. De separerade komponenterna visas till vänster och höger om det ternära komplexet. Kreditera: Natur (2018). DOI:10.1038/nature25010
En ny studie avslöjar molekylstrukturen hos ett protein som kallas alfa(α)Klotho, och hur det hjälper att överföra en hormonell signal som bromsar åldrandet.
Leds av forskare från NYU School of Medicine och publicerades online 17 januari in Natur , studien tillbakavisar 20 år av gissningar om att αKlotho - uppkallad efter den grekiska gudinnan som spinner livets tråd - är ett viktigt anti-aging-hormon. Istället tillskriver resultaten denna funktion till fibroblasttillväxtfaktor 23 (FGF23), och förklara hur αKlotho helt enkelt hjälper FGF23 att förmedla dess anti-aging-verkan.
Studier så långt tillbaka som 1997 hade visat att möss genetiskt manipulerade för att sakna antingen αKlotho eller FGF23 led av för tidigt åldrande, inklusive tidig hjärt-kärlsjukdom, cancer, och kognitiv nedgång. Genom att ge en första titt på strukturen av den associerade gruppen av proteiner som inkluderar FGF23, dess receptorprotein (FGFR), och αKlotho, den aktuella studien kullkastar dogmen att αKlotho fungerar på egen hand som en livslängdsfaktor.
"Genom att visa att alla sätt på vilka αKlotho var tänkt att skydda organ kommer istället från dess förmåga att hjälpa FGF23-signalen, vi har kastat nytt ljus över den bakomliggande orsaken till åldrande, " säger huvudstudieförfattaren Moosa Mohammadi, PhD, professor vid institutionen för biokemi och molekylär farmakologi vid NYU Langone Health. "Våra nya strukturella data banar också väg för utformningen av nya medel som antingen kan uppmuntra eller blockera FGF23-αKlotho-signalering efter behov."
Struktur löser mysterium
För att bestämma atomstrukturen för FGF23-signalgruppen av proteiner, Mohammadi och kollegor använde röntgenkristallografi. Teamet övertalade först FGF23-hormonet, tillsammans med dess receptorprotein (FGFR) och αKlotho, att slå sig ur en lösning och bilda högar av upprepande, ordnade kristaller. De exponerade sedan kristallerna för röntgenstrålar, och använde de reflekterade mönstren för att beräkna proteinernas atomära struktur.
Den nya studien ger det första beviset på hur FGF23 bara kan signalera till celler genom att bilda ett komplex med αKlotho, dess receptor, och en annan partner inom heparansulfat. Tillverkad av benceller, FGF23-hormonet är känt för att resa via blodomloppet till celler i andra organ, där den levererar sitt budskap genom att docka på och slå på sin receptor. Den nyligen lösta komplexa strukturen avslöjar hur αKlotho binder FGF23 till sin receptor med tillräcklig envishet för att aktivera den.
Studien kastar också nytt ljus över hur njursjukdom leder till en onormal förtjockning av hjärtmuskelvävnaden som kallas hypertrofi. Hjärthypertrofi är en ledande dödsorsak hos personer med skadade njurtubuli, orsakas (till exempel) av högt blodtryck och diabetes. När skadade njurtubuli inte längre kan eliminera fosfat i urinen tillräckligt, FGF23 stiger i ett försök att hålla blodfosfat i schack, delvis genom att kontrollera nivåerna av vitamin D. En rådande hypotes har varit att mycket höga nivåer av FGF23 orsakar hypertrofi i hjärtat, men teorin förblev kontroversiell eftersom hjärtvävnad inte har αKlotho, som måste finnas om FGF23 ska signalera.
Tidigare studier har visat att den mest kända formen av αKlotho är orörlig, är bunden till ytmembranen av celler i njurtubuli, bisköldkörteln, och vissa delar av hjärnan. Sedan fick forskarna veta att en del av αKlotho-proteinet som sticker ut från cellytor, ektodomänen, kan skäras av och spridas i cirkulerande kroppsvätskor, och därför kan nå hjärtat. Tidiga bevis, dock, föreslog att shed αKlotho var oförmögen att fungera som en FGF23 co-receptor. Den nya studien integrerar dessa observationer genom att visa att cirkulerande αKlotho verkligen kan fungera precis som dess membranbundna form för att möjliggöra FGF23-signalering.
Forskarna säger att deras fynd kommer att starta ytterligare ett läkemedelsutvecklingslopp mot njursjukdom. Mohammadi hade redan visat att en viktig del av FGF23-hormonet (dess C-terminala svanspeptid), när det injiceras i möss, konkurrerar med intakt FGF23 för att minska dess signal och förhindra hjärthypertrofi. Dessutom, teamet designar redan nya molekyler som förändrar FGF23/shed αKlotho-signalen baserat på de nyupptäckta proteinstrukturerna.
Studien tyder också på att ett relaterat protein, beta-Klotho, fungerar som samma typ av co-receptor för att hjälpa FGF21, ett hormon relaterat till FGF23. FGF21 fungerar genom att skicka signaler som håller blodsocker och fettsyror i balans, med konsekvenser för diabetes och fetma.