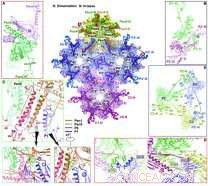
Översikt över interaktionerna på den inre kapsidytan. Upphovsman:WANG Xiangxi
Herpesviruset är genetiskt och strukturellt ett av de mest komplexa virusen. Det sprider sig effektivt inom värdpopulationen, orsakar en rad sjukdomar hos människor, inklusive medfödda störningar och cancer.
Monteringsvägen för herpesvirus producerar tre olika typer av kapsider som kallas A-, B- och C-kapsider, respektive. De tre kapsidtyperna har alla mogna vinkelskal och en liknande monteringsmekanism. Dock, lite är känt om strukturen och sammansättningsmekanismen för herpes simplexvirus (HSV) kapsid.
Med hjälp av en kombination av "blockbaserad" rekonstruktion och exakta Ewald-sfärkorrigeringar, Prof. WANG Xiangxi, Prof. RAO Zihe och prof. ZHANG Xinzheng vid Institute of Biophysics of the Chinese Academy of Sciences, tillsammans med arbetskamrater från Hunan Normal University, och National Institutes for Food and Drug Control, rekonstruerade 3.1 Å-strukturen för herpes simplexvirus typ 2 (HSV-2) B-kapsid och byggde atommodellen, sålunda utökar förståelsen för kapsidens monteringsmekanism. Denna studie publicerades i Vetenskap .
Som ett av de fyra stora strukturella skikten, 125 nm kapsiden av herpesvirus skyddar inte bara det virala genomet mot mekanisk eller annan skada, men fungerar också för att frigöra det virala genomet i värdcellskärnan under initial infektion och att packa genomet under mognaden.
Forskarna fann att det finns fyra stora överensstämmelser för det stora kapsidproteinet VP5, som uppvisar slående skillnader i konfiguration och sätt att montera för att bilda omfattande intermolekylära nätverk.
Triplexen, en heterotrimerisk sammansättning som passar mellan hexamerer och pentamerer vid kvasi-trefaldiga positioner för att cementera kapsiden tillsammans, består av två exemplar av VP23, var och en uppvisar anmärkningsvärt olika konformationer, och ett exemplar av VP19C. Sex kopior av det lilla kapsidproteinet VP26 bildar en ring ovanpå hexonen och stabiliserar ytterligare kapsiden.
Baserat på kapsidstrukturen, forskarna föreslog en modell för ordnad montering av kapsiden med hjälp av en triplex och dess kovalent länkade lassotriangel bildad av tre VP5. Dessa grundläggande monteringsenheter klustrar sedan in i strukturer av högre ordning som överensstämmer med tvåfaldig symmetri och leder mellanliggande sammankopplade mellanprodukter till rätt T =16-geometri, tillåter de första stegen mot att förstå drivkrafterna för montering och grunden för stabiliteten hos kapsiden.