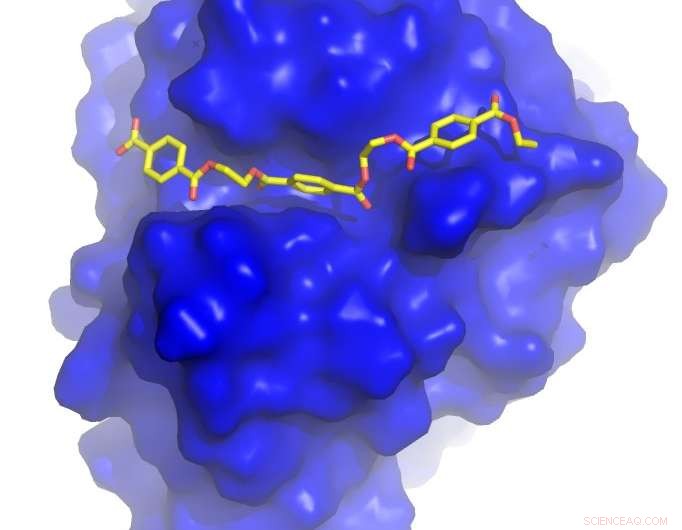
Kredit:University of Portsmouth
Forskare har konstruerat ett enzym som kan smälta några av våra mest förorenande plaster, tillhandahålla en potentiell lösning på ett av världens största miljöproblem.
Upptäckten kan resultera i en återvinningslösning för miljontals ton plastflaskor, gjord av polyetentereftalat, eller PET, som för närvarande kvarstår i hundratals år i miljön.
Forskningen leddes av team vid University of Portsmouth och US Department of Energy's National Renewable Energy Laboratory (NREL) och publiceras i Proceedings of the National Academy of Sciences ( PNAS ).
Professor John McGeehan vid University of Portsmouth och Dr Gregg Beckham vid NREL löste kristallstrukturen hos PETase – ett nyligen upptäckt enzym som smälter PET – och använde denna 3D-information för att förstå hur det fungerar. Under denna studie, de konstruerade oavsiktligt ett enzym som är ännu bättre på att bryta ned plasten än det som utvecklats i naturen.
Forskarna arbetar nu med att förbättra enzymet ytterligare så att det kan användas industriellt för att bryta ner plast på en bråkdel av tiden.
Professor McGeehan, Direktör för Institutet för biologiska och biomedicinska vetenskaper vid School of Biological Sciences i Portsmouth, sa:"Få kunde ha förutsett att sedan plast blev populärt på 1960-talet skulle stora plastavfallsfläckar hittas flytande i haven, eller sköljde upp på en gång orörda stränder över hela världen.
"Vi kan alla spela en betydande roll i att hantera plastproblemet, men det vetenskapliga samfundet som till slut skapade dessa "undermaterial", måste nu använda all teknik som står till deras förfogande för att utveckla riktiga lösningar."
Forskarna fick genombrottet när de undersökte strukturen hos ett naturligt enzym som tros ha utvecklats i ett avfallsåtervinningscenter i Japan, tillåta en bakterie att bryta ned plast som matkälla.
SÄLLSKAPSDJUR, patenterad som en plast på 1940-talet, har inte funnits i naturen så länge, så laget gav sig i kast med att avgöra hur enzymet utvecklades och om det kunde vara möjligt att förbättra det.
Målet var att bestämma dess struktur, men det slutade med att de gick ett steg längre och av misstag konstruerade ett enzym som var ännu bättre på att bryta ner PET-plast.
"Serendipity spelar ofta en betydande roll i grundläggande vetenskaplig forskning och vår upptäckt här är inget undantag, " sa professor McGeehan.
"Även om förbättringen är blygsam, denna oväntade upptäckt tyder på att det finns utrymme att ytterligare förbättra dessa enzymer, flytta oss närmare en återvinningslösning för det ständigt växande berget av kasserad plast."
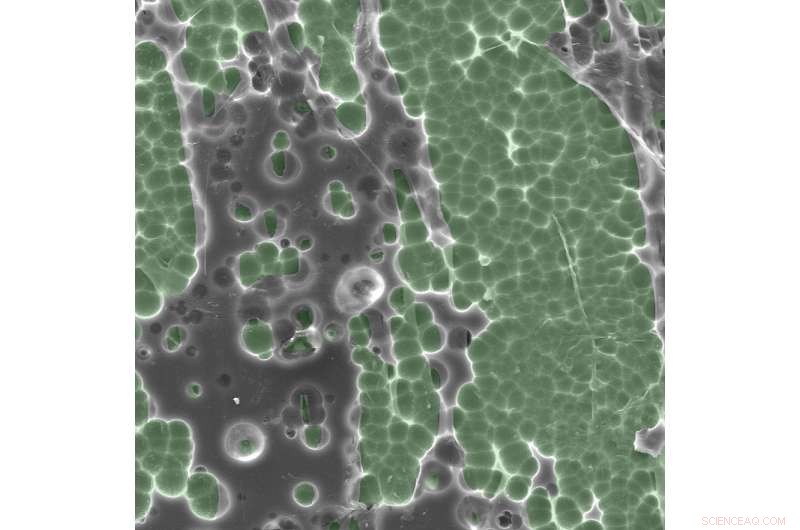
Elektronmikroskopfoton av enzym/substrat-interaktioner. Kredit:Dennis Schroeder / NREL
Forskargruppen kan nu använda verktygen för proteinteknik och evolution för att fortsätta att förbättra det.
University of Portsmouth och NREL samarbetade med forskare vid Diamond Light Source i Storbritannien, en synkrotron som använder intensiva strålar av röntgenstrålar 10 miljarder gånger ljusare än solen för att fungera som ett mikroskop som är kraftfullt nog att se enskilda atomer.
Genom att använda deras senaste laboratorium, strållinje I23, en ultrahögupplöst 3D-modell av PETase-enzymet genererades i utsökt detalj.
Professor McGeehan sa:"Diamantljuskällan skapade nyligen en av de mest avancerade röntgenstrållinjerna i världen och att ha tillgång till denna anläggning gjorde det möjligt för oss att se 3D-atomstrukturen hos PETase i otrolig detalj. Att kunna se de inre funktionerna av denna biologiska katalysator gav oss ritningarna för att konstruera ett snabbare och mer effektivt enzym."
Verkställande direktör för Diamond Light Source, Professor Andrew Harrison, sa:"Med input från fem institutioner i tre olika länder, denna forskning är ett bra exempel på hur internationellt samarbete kan bidra till betydande vetenskapliga genombrott.
"Detaljen som teamet kunde dra ut från resultaten som uppnåddes på I23-strållinjen på Diamond kommer att vara ovärderlig för att skräddarsy enzymet för användning i storskaliga industriella återvinningsprocesser. Effekten av en sådan innovativ lösning på plastavfall skulle vara globalt. Det är fantastiskt att brittiska forskare och anläggningar hjälper till att leda vägen."
Med hjälp av beräkningsmodelleringsforskare vid University of South Florida och University of Campinas i Brasilien, teamet upptäckte att PETase ser väldigt likt ut en cutinase, men den har några ovanliga funktioner inklusive en mer öppen aktiv webbplats, kan ta emot konstgjorda snarare än naturliga polymerer. Dessa skillnader indikerade att PETas kan ha utvecklats i en PET-innehållande miljö för att göra det möjligt för enzymet att bryta ned PET. För att testa den hypotesen, forskarna muterade den aktiva PETase-platsen för att göra den mer som en cutinas.
Och det var då det oväntade hände - forskarna fann att PETase-mutanten var bättre än den naturliga PETasen när det gällde att nedbryta PET.
Betydligt nog, enzymet kan också bryta ned polyetenfurandikarboxylat, eller PEF, ett biobaserat substitut för PET-plaster som hyllas som en ersättning för ölflaskor i glas.
Professor McGeehan sa:"Tillverkningsprocessen är ungefär densamma som för enzymer som för närvarande används i biotvättmedel och vid tillverkning av biobränslen - tekniken finns och det ligger väl inom möjligheten att vi under de kommande åren kommer att se en industriellt hållbar process för att vända PET och potentiellt andra substrat som PEF, PLA, och PBS, tillbaka till sina ursprungliga byggstenar så att de kan återvinnas på ett hållbart sätt."
Tidningens huvudförfattare är doktorand som gemensamt finansieras av University of Portsmouth och NREL, Harry Austin.
Han sa:"Denna forskning är bara början och det finns mycket mer att göra på det här området. Jag är glad över att vara en del av ett internationellt team som tar itu med ett av de största problemen som vår planet står inför."