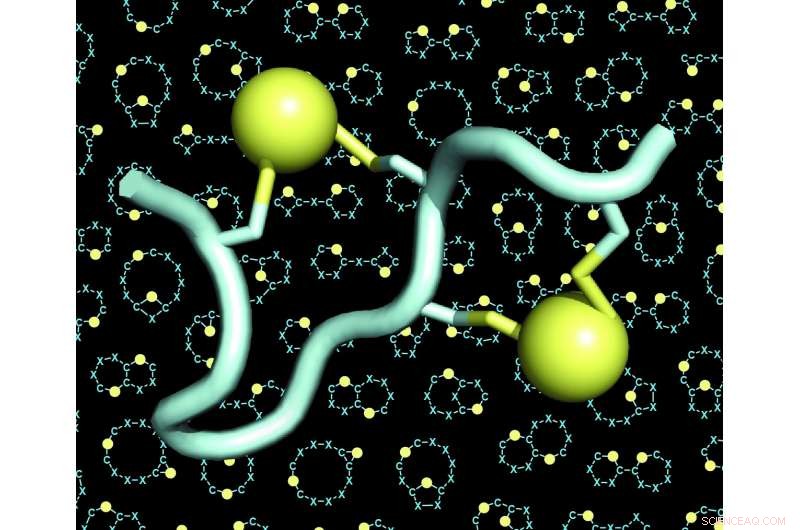
En modell av en dubbelbryggad peptid (peptiden i ljusblått, de två broarna i gult). Bakgrunden till figurerna visar många exempel på skelett (även kallade "ställningar" eller "ryggrader") av dubbelbryggade peptider. Kredit:C. Heinis/EPFL
Peptider är korta kedjor av aminosyror som kan binda till proteiner och ändra deras funktion. De visar hög bindningsaffinitet, låg toxicitet, och är lätta att syntetisera, allt detta gör peptider idealiska för användning i läkemedelsutveckling, och många naturligt förekommande peptider som insulin, oxytocin, somatostatin och antibiotika vankomycin eller polymyxin B, används i stor utsträckning.
Dock, att använda peptider som läkemedel står inför två utmaningar. Först, bindningsaffinitet:Bra bindning kräver svåra peptidarkitekturer och aminosyrasekvenser som är perfekt komplementära i form och laddning till ytan av deras målproteiner. Andra, peptidstabilitet:peptider kan potentiellt skäras av enzymer (proteaser) till mindre, värdelösa fragment eller till och med enstaka aminosyror.
Christian Heinis labb vid EPFL har nu tagit itu med båda dessa utmaningar genom att utveckla det nya peptidformatet som de kallar "dubbelbryggade peptider." Dessa är kedjor med 10 till 15 aminosyror, varav fyra är kemiskt förbundna med två broar. Varje bro förbinder ett par av två cysteinaminosyror - fyra totalt.
Eftersom de fyra cysteinerna kan placeras i många olika konfigurationer längs sekvensen av aminosyror, dubbelbryggningsstrategin gjorde det möjligt för forskarna att generera ett enormt stort antal strukturellt olika peptidarkitekturer. De utökade mångfalden ytterligare genom att använda olika kemiska reagenser som ökade antalet broar. Forskarna fann också att de fyra cysteinerna kunde överbryggas av två länkar på tre olika sätt, ger upphov till tre olika arkitekturer från varje enskild peptidsekvens.
Genom att använda denna strategi, forskarna producerade en enorm mångfald av peptidstrukturer, alla med olika "skelett"-strukturer. Dessutom, kemisterna ändrade systematiskt aminosyrorna mellan cysteinerna och genererade bibliotek med miljarder olika dubbelbryggade peptider. Efter att ha granskat biblioteken, forskarna kunde isolera bindemedel med hög affinitet till viktiga proteinmål. Ett av dessa mål var kallikrein, ett plasmaprotein som är associerat med ärftligt angioödem, en sällsynt svullnadsstörning. En annan var interleukin-17, ett cytokinprotein som är inblandat i flera inflammatoriska sjukdomar såsom reumatoid artrit och psoriasis. Genom att använda dubbelbryggan för båda dessa proteinmål, forskarna utvecklade peptider som kunde binda dem effektivt vid nanomolära koncentrationer. När det gäller kallikrein, peptiderna kunde binda det i mer än en timme innan de dissocierade.
Stabilitet var också ett mycket attraktivt inslag i det nya peptidformatet. De dubbelbryggade peptiderna bryts knappast ned av proteaser i blodet, vilket är en stor fördel eftersom det hindrar peptiderna från att elimineras för snabbt, vilket förlänger deras terapeutiska effekter.Baserat på resultaten, Heinis labb tillämpar nu peptidformatet på många andra sjukdomsmål. De har redan utvecklat nya, även större dubbelbryggade peptidbibliotek och screenade dem mot en rad sjukdomsrelevanta mål. En av dessa peptider genomgår redan preklinisk utvärdering.