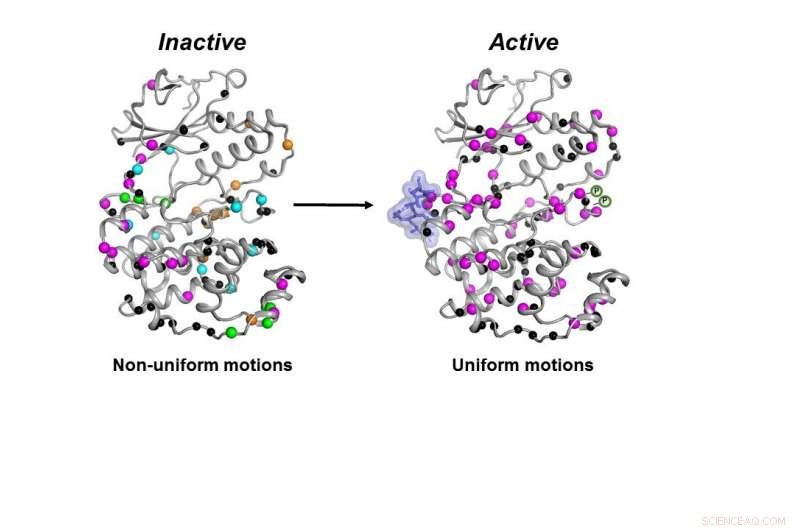
Den inaktiva formen (vänster) av MAPK p38-enzymet rör sig på ett okoordinerat sätt. När de nödvändiga molekylerna (blå blob och P-symboler) binder, enzymet blir aktivt (höger) genom att röra sig på ett koordinerat sätt för att göra sitt jobb inuti en cell. Kredit:Senthil Ganesan, University of Arizona Institutionen för kemi och biokemi.
Att avslöja alla steg som krävs för att aktivera ett enzym som kallas proteinkinas kan identifiera nya sätt att rikta cancer, enligt ny University of Arizona-ledd forskning.
Inte bara måste kinaset ha alla nödvändiga delar på plats, enzymet måste röra sig på rätt sätt och med rätt hastighet för att fungera korrekt i en cell, fann forskarna.
Första författaren Senthil Kumar Ganesan, en UA forskningsassistent professor i kemi och biokemi, nämnda kinaser är omkopplare som slår på eller av vissa cellulära processer. Om en cells kinaser slutade fungera, cellen skulle dö.
Det UA-ledda teamet är den första gruppen som räknar ut hela vägen för att aktivera ett proteinkinas, sa seniorförfattaren Wolfgang Peti, som innehar Homer C. och Emily Davis Weed Endowed Chair i kemi vid University of Arizona.
"Kinaser är ett av de stora cancerläkemedelsmålen, sa Peti, som också är medlem i UA BIO5 Institute och UA Cancer Center. "Om du vet hur en kinas fungerar, du kan definitivt bättre designa dina droger mot det."
Att utveckla ett läkemedel som drar nytta av detta nya forskningsresultat kommer sannolikt att ta minst 10 år, han sa.
Cancerläkemedel som redan används som målkinaser är dasatinib och imatinib för kronisk myeloisk leukemi och afatinib för icke-småcelligt lungkarcinom, sa Ganesan.
För att se ett kinas som kallas mitogenaktiverat proteinkinas (MAPK) p38 i aktion, forskarna använde kärnmagnetisk resonans (NMR) spektroskopi.
Alla nödvändiga molekyler var tvungna att binda till p38 för att enzymet skulle bli aktivt. Först då kunde enzymet röra sig korrekt för att göra sitt jobb i cellen, fann forskarna.
"Vi kom på hur den rör sig för att göra sitt jobb och vad är rörelsehastighetens bidrag till sitt jobb, sa Peti.
Fyndet tyder på att en ny väg för att utveckla läkemedel mot cancer kan vara att skapa läkemedel som stör p38:s rörelse, han sa.
"Vi är glada eftersom detta kinas tillhör en familj av kinaser som kallas MAP-kinaser - nyckelsignalkinaser som reglerar en uppsjö av vägar (inom celler), " han sa.
Peti sa att det nya fyndet kan gälla andra kinaser. Han sa att de många kinasenzymerna i kroppen är mycket lika och sannolikt har liknande vägar till aktivering.
Ganesan, Peti och deras medförfattare publicerade tidningen, "Dynamisk aktivering och reglering av det mitogenaktiverade proteinkinaset p38, " i 1 maj-numret av Proceedings of the National Academy of Sciences .
Deras medförfattare är Michael W. Clarkson och Rebecca Page från University of Arizona; Micha B.A. Kunze, Daniele Granata och Kresten Lindorff-Larsen vid Köpenhamns universitet i Danmark; och A. Joshua Wand från University of Pennsylvania i Philadelphia.
National Institutes of Health anslag NIH-R01GM100910 finansierade forskningen. Data samlades in vid UA Molecular Structures Core och Brown University Structural Biology Core anläggningar.
En ofta använd analogi för hur enzymer fungerar är den med ett lås och en nyckel. En speciell molekyl, nyckeln, passar in i en plats i enzymet, låset. När nyckeln är i låset, enzymet kan börja verka.
Nyckeln-i-låset är nödvändigt för att ett enzym ska fungera, men att aktivera ett enzym är inte alltid så enkelt. Vissa forskare har föreslagit att dynamik - sättet och hastigheten med vilket ett enzym rör sig - är viktigt för att aktivera kinasenzymer.
Peti är intresserad av hur molekyler som kinaser styr processer med celler, så han ville undersöka vilken roll dynamiken spelar. Att lära sig mer om hur molekyler fungerar inuti celler kan hjälpa till att utveckla riktade läkemedel för att bekämpa cancer och andra sjukdomar.
Att ta reda på vilken roll dynamiken spelar i aktiveringen av p38 var svårare och tog längre tid än han förväntade sig.
Verktyget som forskarna använder för att se ett enzym i aktion, NMR-spektroskopi, är svårare med en stor molekyl som p38. Dessutom, teamet var tvungen att utveckla ny datorprogramvara för att analysera resultaten, sa Peti.
Forskarna tittade på enzymet under en rad steg när olika nyckelmolekyler band till p38. Vissa enzymer aktiveras när nyckelmolekyler binder – men inte den här.
"Om du tror att det är en fem- eller sexstegsprocess att gå från noll till 100, vi trodde att vid steg noll, ett, två eller tre, vi skulle få indikationer eller riktlinjer, sa Peti.
Så blev det inte. Han sa att forskarna funderade på att ge upp.
"Ingenting fungerade, och det såg ut som om vår hypotes var helt fel, " han sa.
"Vad vi har är ingenting som händer från noll till ett, det händer ingenting från ett till två, det händer ingenting från två till tre, det händer ingenting från tre till fyra, " sa Peti. "När du går från fyra till fem:Bom! Plötsligt var den där."
När alla dessa steg hade slutförts, även om formen på p38 inte ändrades, dess dynamik gjorde, sa han - och att den sista förändringen i dynamiken krävdes för att enzymet skulle fungera.
Lagets nästa steg, Peti sa, är att se om kinasernas rörelse spelar en roll vid diabetes.