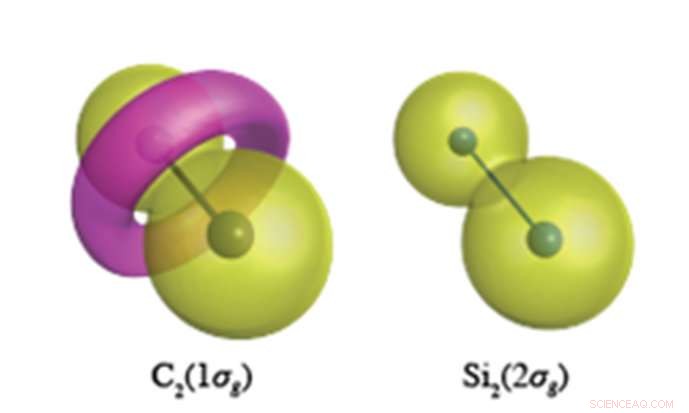
Elektroner i den inre kärnan förväntas ha en jordnötsliknande vågfunktion som visas för Si 2 s elektroner (höger). I C-C-bindningen, dock, C1s-elektronerna bildar en torusliknande egenskap med motsatt polaritet, visas i rosa i vänster figur. Kredit:Yokohama National University
YNU-forskare har löst det urgamla mysteriet om varför kisel inte kan ersätta kol i organiska föreningar. En ny benchmark kvantkemisk beräkning av C 2 , Si 2 , och deras hydrider avslöjar en kvalitativ skillnad i topologierna för kärnelektronorbitaler hos organiska molekyler och deras kiselanaloger. Forskarna föreslår andra element med kols benägenhet att omforma sina kärnelektronnodalstrukturer vid kemisk bindning.
Sedan upptäckten av kisel och Wöhlers framgångar i mitten av 1800-talet med att syntetisera organiska föreningar, Wöhler var själv bland de första som föreslog att man skulle ersätta kol med kisel i organiska föreningar. Det blev klart i början av 1900-talet att kisel inte har en kemi som liknar kol, och drömmar om kiselbaserat liv överlever bara i science fiction. Vi vet empiriskt att kol har förmågan att bilda en mängd olika omättade föreningar, vilket kisel inte gör. Dock, grundorsaken till varför bara kol har denna förmåga har förblivit ett mysterium.
Kvantkemiska beräkningar av oöverträffad noggrannhet utförda vid YNU avslöjar att kärnelektroner (som inte var tänkta att delta i kemisk bindning) har en helt annan roll i de omättade föreningarna av kol och kisel. Kol har en benägenhet att ändra topologin (nodalstrukturen) för sina kärnelektroner, som, för C 2 , resulterar i bildandet av en torusliknande ring i 1σg-orbitalen som bildas av C1s-elektroner (se figur). Si 2 , dock, upprätthåller de sfäriska kärnorbitalerna centrerade vid varje atomär plats i alla dess molekyler. Denna flexibilitet hos kolets kärnorbitaler tillåter kol att bilda ett ymnighetshorn av olika valensbindningsstrukturer, medan kisel är begränsat till bindningsstrukturer ortogonala mot atomliknande sfäriska kärnorbitaler.
Effekten av denna upptäckt är långtgående. Kärnelektroner har hittills antagits mer eller mindre inerta, men kanske blir det nödvändigt att omvärdera deras bidrag till kemisk bindning - åtminstone när det gäller omättade bindningar. Till sist, studien tyder på att andra element, som kväve, fosfor, och fluor, uppvisar liknande flexibilitet för att modifiera sina kärnelektrontopologier, och sålunda, uppvisar liknande rik kemi.
Pappret, "Kärnelektrontopologier i kemiska föreningar:fallstudie av kol kontra kisel, " publiceras i Angewandte Chemie International Edition vol 57(24) den 6 juni, 2018.