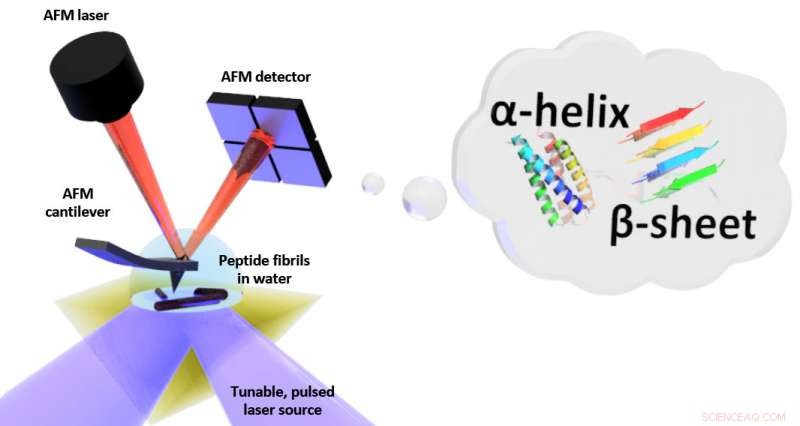
Schematisk inställning för foto-termisk inducerad resonans (PTIR), som inkluderar en infraröd laserkälla och atomkraftmikroskop (AFM) cantilever med en skarp spets som vidrör provet och vibrerar som svar på provets ljusinducerade expansion. PTIR kan bestämma vikningsmönstret (kallas till exempel α-helix, β-ark) av peptider (aminosyrakedjor) i vatten med nanometer-upplösning. Kredit:NIST
Tinkering med en metod som de hjälpte till att utveckla under de senaste åren, forskare har för första gången mätt på nanometerskalan de karakteristiska mönstren för veck som ger proteiner sin tredimensionella form i vatten. Utvecklad av forskare vid National Institute of Standards and Technology (NIST) och deras kollegor, denna teknik kommer att hjälpa forskare att få insikter om biomolekylernas beteende i vattniga miljöer som liknar dem i celler. Dessa insikter, i tur och ordning, kan öka vår förståelse för större sjukdomar, inklusive Alzheimers, som är relaterade till "misstag" i proteinvikning.
Livet som vi känner det kunde inte överleva om proteiner inte fälls in i exakta mönster som leder till spiraler, ark och andra former som ger proteiner sin tredimensionella struktur. De exakta formerna av proteiner gör att de kan transportera syre, avvärja skadliga bakterier och utföra andra viktiga uppgifter i kroppen. Proteiner som viker sig felaktigt kan inte fungera och ibland generera giftiga fragment, såsom de som är associerade med neurodegenerativa störningar.
För att förstå invecklingarna med vikning, forskare måste studera det detaljerade arrangemanget av kedjor av aminosyror som är kortare och enklare än proteiner - kallade peptider - och hur de viks, montera och rotera för att skapa en mängd olika former, eller konformationer. Biologer föredrar att undersöka proteiner och peptider nedsänkta i vatten eftersom den miljön närmar sig förhållandena inuti levande celler.
Tidigare etablerade tekniker för att bestämma proteinets överensstämmelse, såsom infraröd spektroskopi, saknar den fina rumsliga upplösningen för att studera de små och olika sammansättningarna av korrekt vikta och felvikna proteiner. Dessutom, dessa tekniker fungerar inte bra i en vattenhaltig miljö eftersom vatten starkt absorberar infrarött ljus, förvirrar analysen. Vatten hade också ställt till stora utmaningar för en banbrytande teknik, känd som foto-termisk inducerad resonans (PTIR), som nyligen gjorde det möjligt för forskare att undersöka peptidstruktur och konformation i luft med nanoskalaupplösning.
NIST-forskare och deras kollegor har nu visat att PTIR kan anpassas för att erhålla konformationsstruktur på nanoskala i vatten med hjälp av två kemiskt likartade peptider som kallas difenylalanin och Boc-difenylalanin. Difenylalanin är relaterat till beta-amyloid, en kladdig, större peptid kopplad till Alzheimers sjukdom.
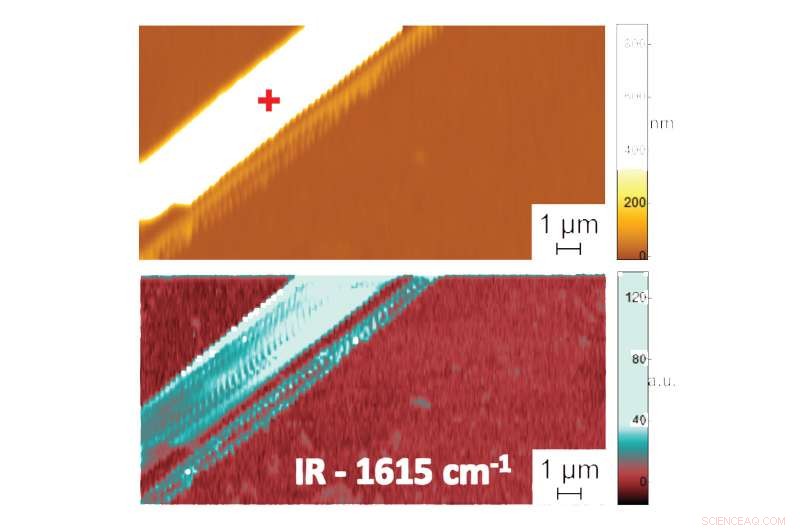
Visas i:Shape in Water:First Nanometer-Scale Measurements of the Folded Structure of Biomolecules in Liquids. Atomkraftmikroskopbild som visar topografi (överst) och PTIR -absorptionsbild som indikerar sammansättning och konformation (botten) av en difenylalaninpeptidfibril i vatten. Ytterligare data, registrerar spektrumet av infraröd strålning som absorberas av peptidfibrillerna, ger information om deras vikningsmönster. PTIR -spektrumet indikerade, till exempel, att difenylalanin antar en ren anti-parallell β-arkkonformation. Kredit:NIST
"PTIR är en kraftfull teknik som redan visat lovande för studier av biologiska system, men möjligheten att använda detta med prover i en flytande miljö kommer att avsevärt förbättra dess användning inom detta område, "sa Georg Ramer från NIST och University of Maryland i College Park. Ramer och NIST -forskaren Andrea Centrone, tillsammans med sina kollegor vid University of Cambridge i England, beskrev deras arbete i en artikel som nyligen publicerades online på ACS Nano .
PTIR bestämmer den kemiska sammansättningen av material med nanoskalaupplösning genom att kombinera ett atomkraftmikroskop (AFM) med ljus från en infraröd laser som fungerar över en rad våglängder. De karakteristiska våglängderna för infrarött ljus som absorberas av provet liknar ett molekylärt fingeravtryck, avslöjar dess kemiska sammansättning. På varje plats på provet där infrarött absorberas, materialet värms upp, får det att snabbt men ändå lite bygga ut. Expansionen upptäcks, med den skarpa spetsen av AFM som sticker ut från en fribärande, som pendlar som en dykbräda varje gång provet expanderar. Ju mer ljus som absorberas av provet, ju större dess expansion och desto större styrka, eller amplitud, av svängningarna.
Så bra som PTIR är, att använda metoden i en vattenmiljö är problematisk. Vatten absorberar starkt infrarött ljus, producerar en absorptionssignal som kan störa försöken att urskilja provets kemiska struktur. Dessutom, dragkraften som utövas av vatten är mycket starkare än i luft och det försvagar vanligtvis PTIR -signalen, eftersom det starkt dämpar svängningarna av AFM:s cantilever.
För att begränsa vattenets absorption av infrarött ljus, laget placerade ett prisma mellan lasern och provet. Prisma tjänade till att begränsa det infraröda ljuset till provets yta, minimera mängden som kan läcka ut och interagera med vattnet. För att åtgärda dämpningsproblemet, laget använde en laser som kunde fungera vid frekvenser upp till 2, 000 kilohertz. Det gjorde det möjligt för forskarna att matcha laserpulsernas frekvens till en av de högre frekvenser vid vilka fribäret oscillerar. Som att trycka ett barn i en gunga i precis rätt intervall, frekvensmatchningen förbättrade amplituden för fribärningens svängningar, delvis kompensera dämpningen på grund av vatten.
För att visa noggrannheten i deras metod, teamet jämförde PTIR -mätningar av difenylalanin och andra peptidprover i två miljöer:vatten och luft. (Peptiderna viks på samma sätt i båda medierna, vilket gör det lättare att göra jämförelsen.) forskarna uppnådde liknande rumslig upplösning och kontrast i vatten och luft, visar för första gången att mätningar i en vattenmiljö kan utföras exakt, avslöjar den exakta konformationen av peptider med nanoskalaupplösning.
"Detta fynd är viktigt för biologer som vill förstå proteinstruktur och vikning i miljöer så nära som möjligt i cellerna, sa Centrone.