
Rice University och Baylor College of Medicine forskare använde datorsimuleringar för att studera processen genom vilken hemagglutinin hjälper virus att invadera och infektera celler. Forskarna tror att proteinets stamdomän vecklas ut och återveckas till en annan konfiguration när den utlöses, men pausar för att frigöra en dold fusionspeptid som binder viruset till målcellen. Klicka på bilden för en större version. Kredit:Xingcheng Lin
Det finns ett problem med ett protein som levererar influensaviruset. Rice University och Baylor College of Medicine forskare tror att denna mekanism kan vara ett användbart mål för att stoppa viruset från att infektera celler.
I en artikel i Proceedings of the National Academy of Sciences, Rice-Baylor-teamet under ledning av biofysikern José Onuchic och biokemisterna Jianpeng Ma och Qinghua Wang fördjupar sig ytterligare i ett glykoproteinkomplex som det började definiera i en uppsats från 2014.
Det där proteinet, hemagglutinin, sitter på ytan av influensavirus och hjälper dem att fästa vid och transportera genom målcellernas skyddande membran.
Tidningen börjar definiera mekanismen som gör att proteinet kan vecklas ut och återvikas på ett ögonblick, ändra sin form för att exponera en peptid som fäster viruset till en cell och börjar infektion. Forskarna tror att terapeutiska läkemedel kan använda denna mekanism för att stänga av viruset.
"Detta protein börjar i ett vikt tillstånd och går igenom en global transformation, återvikas i ett helt annat tillstånd, sa Onuchic, meddirektör för Rice's Center for Theoretical Biological Physics (CTBP). "Men det finns en liten del i centrum som evolutionen har bevarat."
Den enda bevarade aminosyraresten är det knep som gör att proteinet pausar i återveckningsprocessen. Det tillåter en fusionspeptid som är begravd inuti att binda till målcellen och börja infektera den. Utan paus, återvikningen skulle vara för snabb för att bindning skulle kunna ske.
Huvudförfattaren och Rice-postdoktorn Xingcheng Lin modellerade den delen av proteinet, HA2-domänens B-loop. HA2 sitter under en annan domän, en keps känd som HA1 som muterar för att undkomma tidigare försvar. Lin förklarade att HA1 är ett vanligt mål för influensamediciner eftersom den exponerade cap-domänen är mer tillgänglig än den skyddade HA2-domänen.
Problemet är att HA1 ständigt muterar för att motstå droger, han sa. Det påverkar hur effektiva influensavacciner är varje år. Lin och Onuchic sa att HA2 är ett bättre mål för läkemedel eftersom mekanismen är mycket konserverad av evolutionen.
"Om ett läkemedel riktar sig mot HA2, domänen kan inte fly genom att göra mutationer eftersom mutationerna själva skulle göra den icke-funktionell, "Sa Lin. "Den sortens läkemedel kan bli ett universellt vaccin."
HA2 är en trimerisk struktur som, när det utlöses av sura förhållanden i miljön nära en målcell, omvandlar sig själv från en slumpmässig slinga till en lindad spole. Även med paus, den vecklas ut och vikas igen på en bråkdel av en sekund, alldeles för snabbt för mikroskop att se. Men en datorsimulering av processen kan bromsas upp.
Det råkar vara en specialitet för CTBP, som använder program som analyserar energilandskapet för proteiner för att förutsäga hur de kommer att vikas. Onuchic och hans kollegor är pionjärer inom teorin att veckningsproteiner följer en ordnad, "trattad" process som beror på den inneboende energin hos varje atom i kedjan, som var och en ständigt söker sitt lägsta energitillstånd. Om alla atomära "pärlor" kan identifieras, det är möjligt att simulera den komplexa vikningsprocessen.
Risforskarna använder ofta grovkorniga modeller av proteiner, en undergrupp av atomer som representerar helheten, för att förutsäga hur de kommer att lägga sig. Den nya studien var mycket mer ambitiös och gick ut på att förutsäga komplexets utveckling och återveckning genom att använda inte bara varje atom i kedjan utan också varje atom i sin flytande miljö, sa Onuchic.
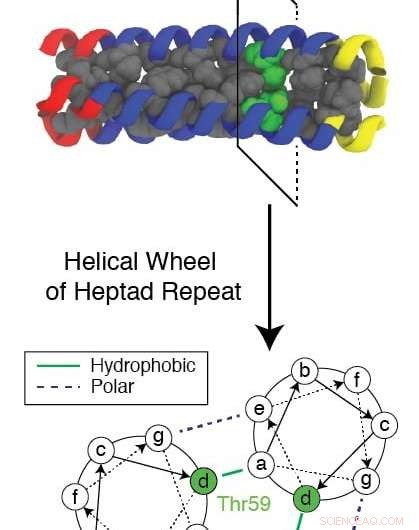
En evolutionärt konserverad rest känd som Thr59 stör det upprepade mönstret som bildas av ett trimeriskt protein när det återveckas samtidigt som det hjälper ett influensavirus att infektera en cell. Forskare vid Rice University och Baylor College of Medicine använde en komplex datorsimulering för att studera mekanismen och leta efter nya mål för läkemedel för att stoppa influensa. Kredit:Xingcheng Lin
Lin modellerade 40 mikrosekunder (miljondelar av en sekund) av HA2-domänövergången som representerar hela processen, som tar 1,4 millisekunder (tusendelar av en sekund) att slutföra. Även den förkortade processen tog två år av datortid för att ge resultat, han sa.
"Den simulerade domänen är cirka 3, 000 atomer, men när miljön, inklusive vatten, redovisas, den totala simuleringen omfattar cirka 100, 000 atomer, " Sa Onuchic. "Det är fortfarande en enorm simulering som krävde state-of-the-art tekniker."
Tidigare teorier baserade på kristallografiska bilder av före-och-efter-proteinerna lade fram idén om en fjäderbelastad domän som verkade fästa vid målcellen efter att locket tagits bort. Onuchic sa att den kompletta modellen av HA2 stöder en annan mekanism.
"Vi kom på att det finns en massa energi som gör sluttillståndet för HA2 mycket mer stabilt än initialtillståndet, " sa han. "Men med den fjäderbelastade mekanismen, det mesta av energin skulle vara bortkastat redan när den bildar den lindade spolen och binder cellen och virusmembranen. Det skulle inte lämna någon energi att dra ihop membranen.
"Det är därför vi bestämde oss för att göra en fullständig beräkning av systemet - alla proteinets atomer och allt vatten, " sa Onuchic. "Det var en gigantisk insats."
Den konserverade hydrofila (vattenattraherande) resten, känd som Thr59, är av särskilt intresse för forskarna, inte bara för hur det stör veckningen och låter viruset attackera, men också för att den har en tvilling.
En simulering av biofysiker från Rice University beskrev den fria energiprofilen som dikterar hur ett protein som hjälper influensaviruset att infektera celler utför sitt uppdrag. Simuleringarna förutsäger hur ett protein kommer att vika sig baserat på de inneboende energierna för varje atom i systemet. Proteinerna bildar slingor och spolar när de söker sitt lägsta, mest stabila energitillstånd (blå). Inom området som forskarna studerade, de hittade ett problem som bromsar veckningsprocessen som gör att bindning till målcellen kan ske och som också ger nya vacciner möjlighet att attackera influensa. Klicka på bilden för en större version. Kredit:Xingcheng Lin
"I hela evolutionära trädet, dessa virus delas in i två grupper, och skillnaden verkar vara denna rest, " Sa Onuchic. "De delade 1, 500 år sedan och på något sätt, efter denna separation, de är helt bevarade. De har inte kunnat ändra resterna oavsett vad, och vi tror att det gör denna rest viktig."
Den aktuella forskningen fokuserade på gruppen som innehåller Thr59 och orsakar H3N2-stammen som är ansvarig för Hongkong-influensan, sa Lin. Den andra återstoden, Met59, förekommer i H1N1-stammen som orsakade spanska sjukan.
"Vi har fortfarande en lång väg kvar att gå för att förstå hela proteinet, " sa han. "Här, vi studerade bara en domän av ett protein, och det finns flera andra som är mycket viktiga för dess funktion."
"Men vad Xingcheng redan har gjort är en beräkningsmässig tour de force, ", tillade Onuchic. "Han visade hur denna speciella rest bryter domänens spiralsymmetri och gör den tillräckligt instabil för att ge peptiden tid att ta tag i membranen."