Kredit:Wiley
Kopplad syreöverföring och elektronöverföringsreaktioner som använder kofaktorer är enzymatiska reaktioner av avgörande betydelse för alla livsformer från bakterier till ryggradsdjur. I den European Journal of Inorganic Chemistry , forskare har introducerat en modell för enzymet sulfitoxidas. Den är baserad på ett molybdenkomplex vars speciella ligander kan oxideras för att möjliggöra koppling av syreöverföring till ett substrat med en intramolekylär elektronöverföring. Mellanprodukter som innehåller molybden(V)-jon spelar en avgörande roll.
Många enzymer fungerar inte ensamma; de kräver kofaktorer - icke-proteinkomponenter som spelar en roll i överföringen av elektroner. Dessa involverar ofta metalljoner, såsom järnet i cytokromer eller spårämnet molybden, som finns i molybdenoxotransferaser, enzymer som överför syreatomer till substrat. En viktig representant för det senare är sulfitoxidas, som oxiderar giftig sulfit för att göra sulfat. Syreöverföringen innebär en förändring av molybdenets oxidationstillstånd från fyrvärt (MoIV) till femvärt (MoV). De inblandade elektronerna avlägsnas med hjälp av cytokromer och används för produktion av ATP. Pentavalent molybden (MoV) verkar vara en mellanprodukt i reaktionen.
Forskare som arbetar med Katja Heinze vid University of Mainz har nu utvecklat ett konceptuellt tillvägagångssätt för att stabilisera och spektroskopiskt karakterisera de förutsagda intermediärerna i reaktionerna av Mo-innehållande oxotransferaser genom att använda modellsystem. De använder en metod som också används för att kontrollera katalysatorer:de fäster en molekylär "switch" med ett kontrollerbart oxidationstillstånd.
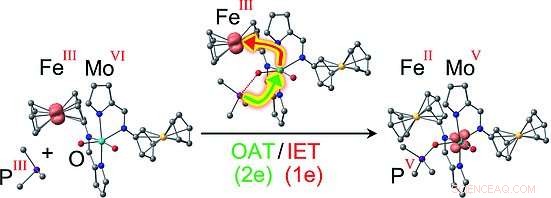
Forskarna valde att använda redoxparet ferrocen/ferrocenium, där en järnatom är inklämd mellan två negativt laddade, aromatisk, femledade kolringar. Järnjonen kan växla mellan ett tillstånd med en dubbel positiv laddning (FeII, ferrocen) och en trefaldigt positivt laddad, oxiderat tillstånd (FeIII, ferrocenium). Detta är analogt med de naturligt förekommande cytokrom-kofaktorerna, som också kan innehålla FeII eller FeIII. Forskarna fäste två av dessa ferrocen/ferrocenium "switchar" till ett molybdenkomplex som en modell för det aktiva centrumet av ett sulfitoxidas. Molybdenet är i VI-oxidationstillståndet och har två syreatomer fästa med dubbelbindningar. Reaktion med en organisk fosfan (en fosfor-kolvätemolekyl) som ett modell syreacceptorsubstrat sker med varierande hastigheter, beroende på laddningarna på "switcharna", eftersom redoxstatusen för ferrocenylsubstituenterna modulerar energibarriärerna för vissa intermediärer. Detta resulterar i en mängd olika addukter mellan Mo-komplexet och fosfanet.
De mest intressanta versionerna är de med två FeIII-joner eller en FeII- och en FeIII-jon:I dessa fall, mekanismen är inte längre en enkel överföring av en syreatom till substratet, som för FeII/FeII-versionen. Istället är det kopplat till en intramolekylär elektronöverföring, möjligen konceptuellt liknande det för naturliga sulfitoxidaser. Under syreöverföringsreaktionen, en elektron överförs från molybdenet till en av FeIII-jonerna, vilket resulterar i en laddningsfördelning av antingen FeII FeIII MoV eller FeII FeII MoV. För den senare versionen, forskarna kunde använda elektronspinresonansspektroskopi för att entydigt detektera MoV-intermediären FeII FeII MoV med det oxiderade substratet (produkten) fortfarande bundet till det. Kopplingen av syreöverföringen till en intermolekylär elektronöverföring sänker aktiveringsbarriären för detta reaktionssteg och stabiliserar samtidigt MoV-mellanprodukten, som förutspåtts av datormodellerna.
Forskarna föreslår att använda detta nya system som en modell för stegen för överföring av syreatomer och intramolekylära elektronöverföringar i sulfitoxidaser, och hoppas kunna använda detta nya koncept för att utveckla analoger för ytterligare enzymatiska reaktioner med kopplad elektronöverföring. I framtiden, det verkar också möjligt att utvidga detta koncept till omkopplingsbara katalytiska reaktioner som inte har någon naturlig prototyp.