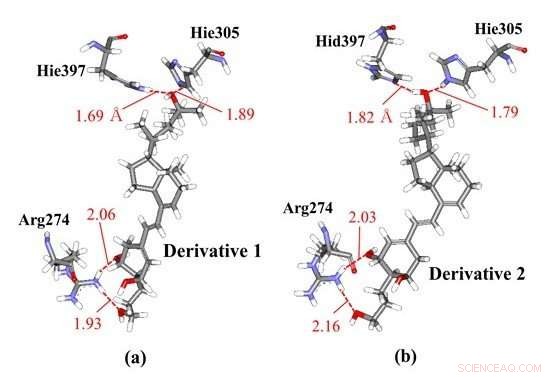
Vätebindningsinteraktioner mellan vitamin-D-derivat och aminosyrarester i VDR; (a) derivat 1 och (b) derivat 2 som har samma kemiska strukturer men olika kiraliteter. Våra ab initio molekylära simuleringar visade att derivat 1 interagerar med Hie397 och Hie305, medan derivat 2 interagerar med olika protonerade histidinrester, såsom Hid397 och Hie305, vilket indikerar att skillnaden i kiralitet hos derivaten kan inducera förändringar i histidinprotonationstillstånd hos VDR-proteinet. Kredit:Toyohashi University of Technology
Forskare vid Toyohashi University of Technology, i samarbete med forskare vid Teijin Pharma Ltd. och Teikyo University, har lyft fram möjligheten att kiralitet hos vitamin D-derivat kan påverka protonationstillstånden för histidinrester i vitamin D-receptorproteinet via ab initio molekylära simuleringar och biomedicinska analyser. Detta fynd understryker att protonationstillstånd bör beaktas mer exakt i molekylära simuleringar, när man undersöker specifika interaktioner mellan läkemedelskandidater och målproteiner relaterade till sjukdomspatogenes.
Vitamin D spelar många viktiga roller i uppkomsten av immunologiska sjukdomar, samt reglering av kalciumnivåer i blodet. Dessa fysiologiska effekter orsakade av aktivt vitamin D utlöses av den specifika interaktionen av aktivt vitamin D med vitamin D-receptorn (VDR); många typer av vitamin D-derivat har utvecklats som potenta ligander mot VDR. Bindningsaffiniteten mellan humana VDR och vitamin D-derivat har rapporterats vara signifikant beroende av derivatets kiralitet.
Dock, orsaken till beroendet har inte klarlagts, vilket gör det till en flaskhals i utvecklingen av nya och potenta läkemedel mot immunologiska sjukdomar, vars debut är relaterad till aktiveringen av VDR.
Nu, forskare vid institutionen för datavetenskap och teknik vid Toyohashi University of Technology och vid Teijin Pharma Ltd. och Teikyo University har visat möjligheten att kiraliteten hos vitamin D-derivat kan påverka protonationstillstånden för histidinrester i VDR-proteinet baserat på resultaten utvärderad av toppmoderna molekylära simuleringar och K-datorn från RIKEN.
Forskare har observerat de specifika interaktionerna mellan VDR och vissa vitamin D-derivat med olika kiraliteter med hjälp av ab initio fragment molecular orbital (FMO) beräkningar. FMO-resultaten avslöjar att två histidinrester i VDR bidrar signifikant till bindningen av VDR med derivaten och att protonationstillstånden för dessa rester kan påverka de specifika interaktionerna. Därför, forskarna övervägde de andra möjliga protonationstillstånden för dessa histidinrester och bestämde de mest stabila tillstånden med hjälp av ab initio FMO-beräkningar. Resultaten illustrerade, för första gången, möjligheten att skillnaden i chiraliteterna hos vitamin D-derivat kan inducera förändringar i protonationstillstånd för histidinresterna i VDR som finns nära derivatet. På grund av denna förändring i protonationstillståndet, derivaten kan binda starkare till VDR och kan därmed producera mer stabila komplex med den.
Detta fynd ger en viktig och viktig varning för de molekylära simuleringarna att överväga protonationstillstånd av histidinrester i proteiner mer exakt samtidigt som man undersöker de specifika interaktionerna mellan proteiner och ligander.
"Vi har använt sofistikerade molekylära simuleringar och K-datorn för att finna att protonationstillstånden för histidinresterna i VDR förändras avsevärt med förändringar i ligandens kiralitet, " förklarar docent Noriyuki Kurita, "Eftersom histidinrester finns i många proteiner som är involverade i patogenesen av sjukdomar, vi bör överväga deras protonationstillstånd mer exakt via in silico läkemedelsdesign baserat på molekylära simuleringar."
Den första författaren, doktorand Yuta Terauchi, sa, "Vårt slutliga mål är att utveckla nya och potenta läkemedel som kan aktivera VDR baserat på våra ab initio molekylära simuleringar, såväl som på grundval av biomedicinska studier utförda av våra medarbetare."
Författarna deltar i ett in silico drug design consortium - fragment molecular orbital drug design (FMODD) konsortium - där olika forskare från universitet, läkemedelsföretag, and national institutes are investigating the specific interactions between disease-related proteins and many types of candidate drugs using ab initio molecular simulations based on the FMO method and the K computer. Similar molecular simulations are underway now for a huge number of vitamin D derivatives in order to propose novel ligands for VDR, which can act as candidate for potent drugs against immunological diseases, såsom cancer.