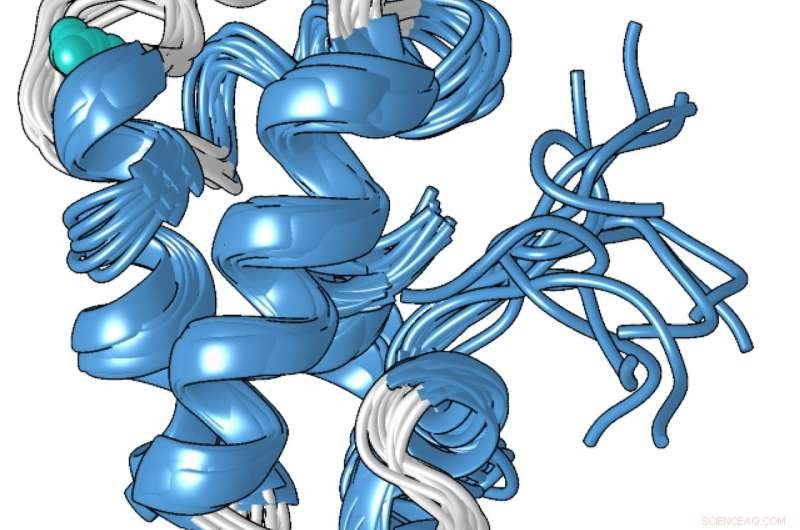
En strukturell modell av den kompakta metallbundna formen av lanmodulinproteinet, som är 100 miljoner gånger bättre på att binda till lantanider - de sällsynta jordartsmetaller som används i smartphones och andra tekniker - än till andra metaller som kalcium. Kredit:Penn State
Ett nyupptäckt protein kan hjälpa till att upptäcka, mål, och samla ur miljön de sällsynta jordartsmetaller som används i smartphones. Två nya studier av forskare vid Penn State beskriver proteinet, som är 100 miljoner gånger bättre på att binda till lantanider-de sällsynta jordartsmetaller som används i smartphones och annan teknik-än till andra metaller som kalcium. Den första studien, som visas i Journal of the American Chemical Society , beskriver proteinet, och den andra tidningen, som visas online i tidningen Biokemi , beskriver dess unika struktur, vilket sannolikt spelar en roll i dess anmärkningsvärda selektivitet för lantanider.
"Nyligen, det har funnits ett stort intresse för att öka tillgängligheten för sällsynta jordartsmetaller som lantanider, som används i skärmar och elektronik på smartphones, batterier i hybridbilar, lasrar, och andra tekniker, "sa Joseph Cotruvo Jr. biträdande professor och Louis Martarano karriärutvecklingsprofessor i kemi vid Penn State och författare till båda studierna. "Eftersom de fysiska egenskaperna hos sällsynta jordartsmetaller är så lika, det kan vara svårt att rikta in sig på och samla in en i synnerhet. Att förstå hur detta protein binder lantanider med så otroligt hög selektivitet kan avslöja sätt att upptäcka och rikta dessa viktiga metaller. "
Forskargruppen upptäckte proteinet, som de kallade lanmodulin, inom bakterien Methylobacterium extorquens, som växer på växtblad och i mark och spelar en viktig roll för hur kol rör sig genom miljön. Bakterierna kräver lantanider för att vissa av deras enzymer ska fungera korrekt, inklusive en som hjälper bakterierna att bearbeta kol, som krävs för dess tillväxt.
"Dessa bakterier behöver lantanider och andra metaller som kalcium för att växa, ", sa Cotruvo. "De behöver ett sätt att få ut varje metall från miljön och se till att varje metall hamnar på rätt plats i cellen. Det verkar som om dessa bakterier har utvecklat ett unikt sätt att rikta lantanider i miljön, där de är mycket mindre rikliga än andra metaller som kalcium. "
Proteinets unika struktur, som Cotruvo bestämde i samarbete med Scott Showalters labb, docent i kemi vid Penn State, kan förklara varför det är 100 miljoner gånger bättre att binda lantanider över kalcium. I avsaknad av metall, Cotruvo förklarade, proteinet är mestadels ostrukturerat, men när metall är närvarande, det ändrar konformation till en kompakt, väl definierad struktur.
Den nya kompakta formen innehåller fyra strukturer som kallas "EF -händer". Mänskliga celler innehåller många proteiner med EF -händer, som är involverade i att använda kalcium för funktioner som nervceller som avfyrar och muskler drar ihop sig. Dessa proteiner binder också lantanider, även om lantanider inte är fysiologiskt relevanta hos människor och att proteinerna bara är 10 eller 100 gånger mer benägna att binda lantanider än att de binder kalcium. Den kompakta strukturen av lanmodulinproteinet innehåller också en aminosyra som kallas prolin i en unik position i var och en av EF-händerna, vilket kan bidra till proteinets lantanidselektivitet.
"Mekanismen för lanmodulins selektivitet för lantanider är ännu inte klar, men vi tror att det beror på den strukturella förändring som sker i närvaro av metaller, "sa Cotruvo." Denna strukturförändring är viktig för proteinets funktion; till exempel, vissa protein-protein-interaktioner kan hända endast när proteinet är i sin kompakta form. En mycket liten mängd lantanider krävs för att inducera konformationsförändringen, men det skulle ta mycket mer kalcium, mer än vad bakterierna kan ha, för att faktiskt framkalla förändringen. Detta skulle bidra till att säkerställa selektivitet för lantanider inuti celler. "
Att förstå hur proteinet är så selektivt kan ge insikter för insamling av lantanider för industriella ändamål, inklusive utvinning från gruvavfallsströmmar.
"Att bearbeta dessa strömmar för att separera sällsynta jordartsmetaller från andra metaller på ett ekonomiskt sätt är utmanande, sa Cotruvo, "både på grund av de sällsynta jordarnas låga överflöd och deras olöslighet, kräver stora mängder syra för att hålla dem i lösning. Att sänka pH sänker vanligtvis affiniteten mot metaller, men vi tror att detta protein börjar med så hög affinitet att det kan hjälpa till att övervinna dessa utmaningar. Vi undersöker för närvarande denna möjlighet. "
Förutom att utforska proteinets selektivitetsmekanism och funktionen hos de unikt placerade aminosyrorna, forskargruppen undersöker också proteinets affinitet för andra metaller, eftersom lantanider ofta finns i närvaro av andra metaller, inklusive järn, mangan, och aluminium, som förekommer i större mängder.
"Vi är också mycket intresserade av proteinets biologiska funktion, ", sa Cotruvo. "Men i slutändan hoppas vi att förståelsen av proteinet kommer att leda till mer miljövänliga sätt att förvärva sällsynta jordartsmetaller från miljön."