Upphovsman:Wiley
De imponerande höga omvandlingshastigheterna för naturliga enzymer är delvis ett resultat av att öka den katalytiska aktiviteten hos ett fåtal utvalda aminosyrasidokedjor genom exakt positionering i proteinbindningshålan. Forskare har nu visat att sådan finjustering också är möjlig för "designer" enzymer med onaturliga katalytiska aminosyror. I journalen Angewandte Chemie , de rapporterar att laboratorie-"evolution" av ett designerenzym med en anilin-sidokedja ledde till varianter med betydligt högre aktivitet.
Den hastighet och selektivitet med vilken enzymer i naturen katalyserar omvandlingar är avundsvärda. För att katalytiskt öka onaturliga reaktioner, forskare härmar enzymer med hjälp av proteinramar som realiseras genom datorstödd proteindesign. Ytterligare optimering uppnås genom upprepning av en darwinistisk cykel:1) diversifiering genom mutation, 2) identifiering av förbättrade katalysatorer, och 3) amplifiering av de mer effektiva enzymvarianterna. Detta möjliggör produktion av designerenzym med mycket höga aktiviteter.
Forskare under ledning av Clemens Mayer och Gerard Roelfes vid University of Groningen (Nederländerna) har nu visat att denna typ av riktad evolution också är en metod för att förbättra effektiviteten hos en ny klass av designerenzym:enzymer som innehåller en aminosyra som är inte utnyttjas av naturen.
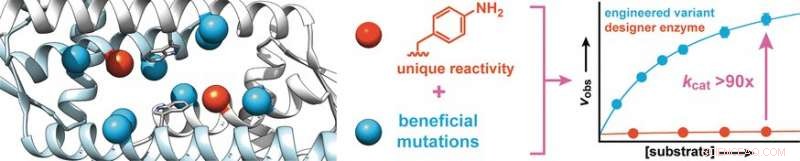
Börjar med ett protein från Lactococcus lactis, en bakterie som används vid tillverkning av mejeriprodukter som ost och kärnmjölk, forskarna syntetiserade ett designerenzym som innehåller en aminosyra med en abiotisk anilinsidokedja (aminofenylalanin). Som gratis anilin, denna aminosyra katalyserar reaktionen av aldehyder med hydraziner eller hydroxylaminer för att göra hydrazoner eller oximer, respektive.
För att öka enzymets aktivitet, forskarna producerade enzymvarianter med mutationer vid aminosyror nära anilinsidokedjan. Screening av cirka 400 mutanter gav två kandidater med bättre aktivitet, varav en utsattes för en andra evolutionär omgång. Detta ledde till upptäckten av mer fördelaktiga mutationer. För att identifiera synergetiska effekter, flera gynnsamma mutationer kombinerades för att producera ytterligare varianter. På det här sättet, det var möjligt att öka omvandlingshastigheten för enzymet med en faktor 90.
Forskarna betonar att liknar naturliga enzymer, "denna drastiska ökning är baserad på att stärka den inneboende katalytiska aktiviteten hos anilinsidokedjan. Vi avser att använda denna princip för att införliva ytterligare organiska katalysatorer som sidokedjor i enzymer, och att använda riktad evolution för att omvandla dessa till mycket effektiva designerenzym som snabbt och effektivt kan utföra syntetiskt viktiga reaktioner som annars bara skulle gå väldigt långsamt. "