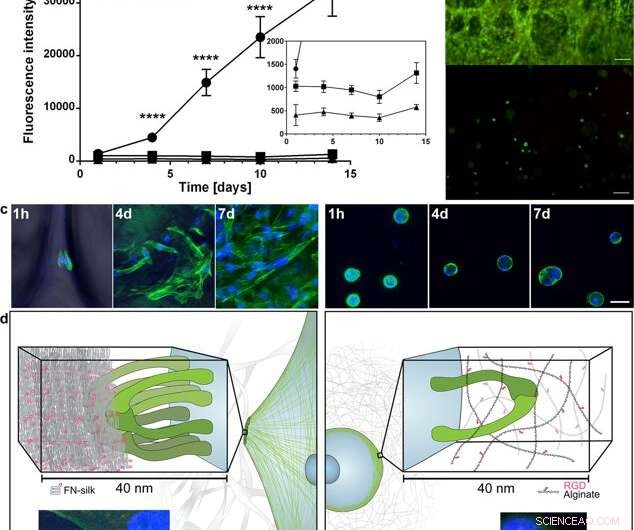
Spridning och expansion av celler i FN-silke jämfört med när de är inkapslade i en RGD-kopplad hydrogel. (a) Representativt diagram (medelvärde och standardavvikelse) för Alamar Blue-viabilitetsanalys som visar metabolisk aktivitet av fibroblaster (HDF) i FN-silkesskum (cirkel), en mycket låg viskositet (VLVG) alginathydrogel kopplad med RGD (fyrkantig), och en alginathydrogel med medium viskositet (MVG) kopplad med RGD (triangel) under två veckors odling. Infoga visar en inzoomad bild av de lägre intensiteterna. Statistik (studenters t-test vid varje tidpunkt):**** indikerar p < 0,0001 (n = 12) (b) Representativ levande (grön) och död (röd) färgning av mänskliga mesenkymala stamceller (HMSC) i FN- silkesskum (övre) och RGD-kopplat alginat VLVG (nedre) vid dag 14. Skalstaplar = 100 µm. (c) Konfokala skanningar av HMSCs integrerade i FN-silkeskum (vänster panel), och RGD-kopplad alginathydrogel MVG (höger panel) efter 1 h, 4 dagar och 7 dagar. Aktinfilament visualiseras genom falloidinfärgning (grön) och cellkärnor färgas med DAPI (blå). Skalstaplar = 20 µm. (d) Schematisk beskrivning av hypotesen för orsaken bakom den observerade skillnaden i interaktioner mellan celler och silke (vänster) kontra RGD-kopplade alginathydrogeler (höger). Flera integrinpar (gröna) kan fästa och samlas på silkesmikrofibrerna, bildar fokala vidhäftningar vid kanten av aktinfilament, gör det möjligt för cellerna att spridas och föröka sig. I alginathydrogelen, ett enda integrinpar (grönt) kan binda till det kopplade RGD-motivet, men de tunna alginatkedjorna begränsar efterföljande ansamling till fokala vidhäftningar. Insatser visar exempel på en cell (fibroblast) efter 3 h i FN-silkesskum (vänster) och en alginathydrogel med låg viskositet (VLVG) kopplad med RGD (höger). Aktinfilament visualiseras genom falloidinfärgning (grön), och fokala vidhäftningar kan ses där detta är samlokaliserat med färgning för vinkulin (röd, markerade med pil). Cellkärnor färgas med DAPI (blå). Kredit:Scientific Reports, doi:10.1038/s41598-019-42541-y
Biologiska vävnader byggs upp när celler förankras till specifika platser på ett 3-D mikrofibernätverk i en extracellulär matris (ECM). Forskare är angelägna om att återskapa biologiska vävnader i labbet med hjälp av bioinspirerad vävnadsteknik och genteknik, för att bilda funktionella ECM-motiv sammansmälta med rekombinanta sidenproteiner. Under adekvata fysiologiska förhållanden, biokonstruerade sidenproteiner och fibronektinsilke (FN-silke) kan självmontera till mikrofibernätverk som efterliknar naturligt ECM.
I en nyligen genomförd studie, Ulrika Johansson, Mona Widhe och medarbetare på de tvärvetenskapliga institutionerna för bioteknik, Biomaterialkemi, och immunologi i Sverige utvecklade en metod för att inkludera däggdjursceller i en silkeslösning innan silke sätts samman till konstruktioner, för att bilda enhetliga cellintegrerade vävnadsliknande mikrofibrer. De resulterande 3D-ställningskonstruktionerna visade förbättrad cellproliferation (tillväxt) och homogen cellspridning jämfört med celler inkapslade i hydrogel. Resultaten av studien publiceras nu i Vetenskapliga rapporter .
Forskarna bekräftade cellvidhäftning på fibronektin-silkekonstruktioner (FN-Silk) i arbetet genom att observera filamentöst aktin och genom att definiera fokala vidhäftningspunkter för det fästa, långsträckta celler. De bibehöll cellviabiliteten i 90 dagar i cell-FN/silke-ytorna och visade skalbarhet hos metoden till 3D-cellkulturer i makrostorlek. Silkesmikrofiberbuntarna med inkapslade celler bibehöll biomekanisk styrka och utdragbarhet ungefär som mänskliga artärväggar.
Protokollet utvecklat av Johansson och Widhe et al. tillät också stamceller att differentiera inuti 3D-konstruktionerna för att hjälpa tillväxten av olika cellsamkulturer. De visade att endotelceller kunde inkluderas i de bioinspirerade materialen för att bilda kärlliknande strukturer genom hela vävnadskonstruktionerna. Forskarna föreställer sig att använda det ECM-liknande nätverket som en grund för framtida ansträngningar för att konstruera funktionella biologiska vävnader i labbet.
In vitro däggdjurscellkultur är en oumbärlig experimentell teknik i grundforskning och industriella tillämpningar, även om den befintliga processen förlitar sig på 2D hårdplast eller glasytor för enkelhetens skull – vilket försämrar det naturliga biologiska svaret. Eftersom biologiska celler naturligt är vana vid att ta emot signaler från 3D-miljön, vävnadsingenjörer har skapat nya experimentella strategier med hjälp av 3D-cellkulturer. De experimentella förhållandena bibehöll celladhesion, spridning och differentiering för att återskapa och upprätthålla cellmetabolism och funktionalitet i labbet.
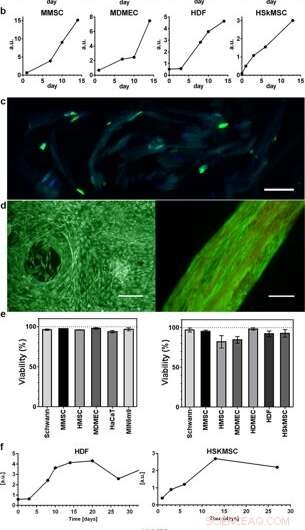
Proliferation och livsduglighet av celler integrerade i 3D-silke. Representativa diagram av Alamar blå viabilitetsanalys visar ökande metabolisk aktivitet under de första 2 veckorna inom (a) skum (N = 3–4, n = 3–7), och (b) fibrer (N = 1–9, n = 2–13), återspeglar tillväxten av de olika integrerade celltyperna (HaCaT; human keratinocytcellinje, HDF; mänskliga dermala fibroblaster, MDMEC; mus dermala mikrovaskulära endotelceller, MIN6m9;insulin-utsöndrande mus pankreatisk β-cellinje). (c) Celldelning sker djupt i 3D-silket. Kryosektion av en fiber med integrerade fibroblaster (HDF) fixerade vid dag 11 och färgade med FITC-anti BrdU för nysyntetiserat DNA (grönt) och DAPI (blått). Silket visar en svag autofluorescens i det blå/gröna området. (d) Representativ levande (grön) och död (röd) färgning av mesenkymala stamceller från mus (MMSC) i skum (vänster) och HDF i fiber (höger) på dag 14. Fibern visar en svag autofluorescens i det röda området. Skalstaplar = 100 µm. (e) Viabilitet (%, medelvärde och standardavvikelse) efter 14 dagars odling av olika celltyper (se tilläggstabell 1) i skum (vänster graf), och i fibrer (höger graf) (N = 1–3, n = 4). (f) Långtidskulturer av celler integrerade i fibrer bibehöll metabolisk aktivitet (Alamar blå) under hela studieperioden (upp till 97 dagar). Kredit:Scientific Reports, doi:10.1038/s41598-019-42541-y
Tidigare, Johansson och Widhe m.fl. hade utvecklat en skalbar process för att konstruera det rekombinanta spindelsilkeproteinet känt som 4RepCT för bioinspirerad cellkultur i labbet, som självmonteras till biologiskt nedbrytbara och biokompatibla mikrofibrer i vattenhaltiga, fysiologiska buffertar vid rumstemperatur. De funktionaliserade den nya konstruktionen med hjälp av ett cellvidhäftningsmotiv från fibronektin (FN) för att bilda FN-silkesmaterialet och främja fast cellvidhäftning. Även om celler förökade sig längs de nya materialytorna, de förblev ensamma på ytan, oförmögna att proliferera in i konstruktionerna för att adekvat efterlikna vävnadsliknande egenskaper in vitro. I detta arbete, forskarna utvecklade därför en ny metod, för att effektivt bädda in celler i silkesmaterialet under monteringen av FN-silke för inkapslad och livsduglig 3-D cellkultur som adekvat efterliknade den extracellulära matrisen in vitro.
Vävnadsteknik cellinbäddade sidenkonstruktioner i labbet
Under experimenten, Johansson och Widhe et al., först tillsatte en droppe dispergerade stamceller (mesenkymala musstamceller, MMSC) till FN-silkeproteinlösningen före lösningsmontering. Efter inkubation, det nybildade nätverket förblev stabilt i odlingsmedia och antalet inkapslade celler ökade i konstruktionerna under hela odlingsperioden. Efter tre dagar, cellerna sprids över alla dimensioner av skummet, som forskarna observerade med hjälp av differential interference contrast (DIC) mikroskopi.
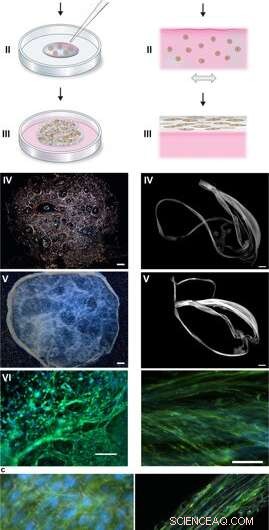
Silkesmontage för att integrera celler i ett 3D-nätverk av mikrofibrer. (a) Schematisk beskrivning av bildandet av silkesskum med ingrodda celler. Celler suspenderade i odlingsmedium (rosa) tillsätts till en definierad droppe FN-silkeproteinlösning (blå) placerad i mitten av en obehandlad odlingsbrunn (I). Luftbubblor införs snabbt (5–10 sek) genom en pipettspets (II), för att ge upphov till ett 3D-skum med celler. Efter 30 minuter i cellinkubatorn, ytterligare odlingsmedium tillsätts för att täcka skummet helt (III). Dag 1 efter formulering, sidenskummet med celler ser nästan genomskinligt ut, även om den innehåller några kvarvarande luftbubblor (som försvinner med tiden) (IV). Efter 2 veckors kultur, skummet med integrerade celler visar ett tätare och vitare utseende (V). Redan på dag 3 är skummet fyllt med väl spridda celler (här visas mesenkymala stamceller från mus (MMSC) (VI). Aktinfilament visualiseras av falloidin (grönt) och cellkärnor genom DAPI-färgning (blå). Skalstång IV-V = 1 mm, VI = 100 µm. (b) Schematisk beskrivning av silkesfibrer bildade med integrerade celler. Celler suspenderade i medium (rosa) tillsätts till FN-silkesproteinlösningen (blå) (I). Under försiktig upprepad enaxlig lutning i 1–3 timmar (II) samlas silkesproteinerna vid luft-vätskegränsytan till ett makroskopiskt knippe av mikrofibrer med inbyggda celler (III). Silkesfibrerna med celler hämtas lätt (IV) och kan placeras i en brunn för vidare odling, varvid tjockleken ökar under 2 veckor (V). På dag 3, inriktade celler (här MMSC) hittas spridda integrerade i fiberknippet (VI). Aktinfilament visualiseras av falloidin (grönt) och cellkärnor genom DAPI-färgning (blå). Skalstång IV-V = 1 mm, VI = 100 µm. (c) Differential Interference Contrast (DIC) mikrofotografier av silkesmikrofibrerna (vita) i en fiber (vänster) och ett skum (höger) med integrerade celler (MMSC). Aktinfilament visualiseras av falloidin (grönt) och cellkärnor genom DAPI-färgning (blå). Skalstång = 50 µm (vänster) och 100 µm (höger). Kredit:Scientific Reports, doi:10.1038/s41598-019-42541-y
De riktade cellinriktningen för att bilda ett slumpmässigt 3D-nätverk av mikrofibrer som framgångsrikt efterliknade biologiska vävnader genom att bilda ett makroskopiskt knippe av mikrofibrer under cellodlingens tidslinje, följt av cell till ECM-förhållandeundersökning. Forskarna varierade ECM till cellsammansättning för att efterlikna eller matcha en rad vävnadstyper, inklusive cellglesa och högdensitetsvävnader i levern. Metoden lämpar sig därför även för 3D-cellodling med små cellmängder.
Testa cellviabilitet på sidenställningarna – cytokompatibilitetsstudier
Forskarna använde tillväxtprofiler för att kartlägga de olika celltyperna inbäddade i både skum och fibrer i silkesenheten. De observerade en ökad signal från den metaboliska aktiviteten för att representera cellproliferation i 3D-silkesställningarna och med tiden visade de ökad celltäthet i den innersta cell-silkesställningen. Johansson et al. undersökte cellproliferation med BrdU-färgning, där positiva resultat visade djupare spridning och cellspridning i silkesfibrerna för att bibehålla cellviabiliteten efter 2 veckors inkapsling, och under långvariga cellodlingsperioder som sträckte sig över en till tre månader.
Jämförelse av cytokompatibiliteten hos silke och hydrogelbiomaterial
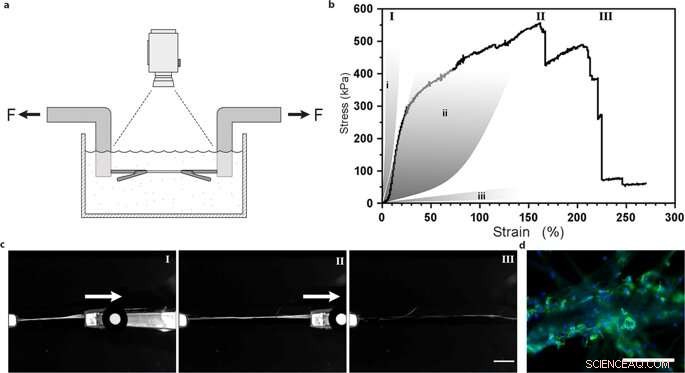
Uniaxiell dragprovning av silkesfibrer med integrerade mesenkymala stamceller. (a) Illustration av den experimentella uppställningen för dragtester utförda i PBS-buffert vid 37 °C för att upprätthålla livsdugliga celler. (b) Representant Första Piola-Kirchhoff stress kontra töjningskurva för en FN-silkefiber med integrerade mesenkymala stamceller (MMSC) utsatta för dragprovning efter 14 dagars odling. Spännings-töjningskurvan illustrerar en ganska linjär (och troligen elastisk) fas som följs av en plastliknande (irreversibel) deformationsfas tills maximal spänning uppnås, och fibern går sönder. För jämförelse, grå områden representerar olika spänningsegenskaper i senor och ligament (i), artärväggar (ii), och hjärnvävnad (iii). Romerska siffror hänvisar till bilder (c) tagna under dragprovet, dvs under start (I), förlängning (II) och brott (III) av fibrerna. Skalstång = 5 mm. (d) Mikrofotografier av brottpunkten för fibrer med MMSCs efter dragprovning. Aktinfilament visualiseras genom falloidinfärgning (grön) och cellkärnor färgas med DAPI (blå). Skalstaplar = 200 µm. Kredit:Scientific Reports, doi:10.1038/s41598-019-42541-y
Baserat på de uppmuntrande preliminära resultaten, forskarna genomförde parallella experiment för att jämföra celltillväxt i silke vs. celltillväxt i hydrogel för att fastställa cytokompatibiliteten hos de två materialen. De valde alginat för att representera hydrogelen under cellodling och observerade olikheter mellan alginat och silke, registrerar tydlig cellexpansion i silke, medan celler i alginat förblev i ett stabilt metaboliskt tillstånd. Med hjälp av konfokalmikroskopi, de undersökte orsaker till den observerade skillnaden i celltillväxt på nivån av mikromiljön. Resultaten visade snabb cellvidhäftning (sedd med långsträckta celler) i silkeskonstruktionerna, medan alginatkonstruktionerna drogs samman under cellodling, vilket kan ha stressat cellerna att lossna.
Biomekaniska studier – karakterisering av de nya materialen
De fastställde att materialytans styvhet var en avgörande komponent som påverkade cellens öde. För att verifiera denna observation, Johansson et al. testade biomekaniska beteenden hos silkeskonstruktionerna för att säkerställa att de på ett adekvat sätt efterliknade naturlig vävnad. De genomförde dragprovning i en fysiologisk buffert för att få resultaten, vilket bevisade att de mekaniska egenskaperna hos silkeinnehållande celler matchade de hos bindväv som artärväggar. Johansson et al. kunde demonstrera hög utdragbarhet av mikrofibrerna för att indikera kraftövergång in i och genom cellerna fästa vid det nya biomaterialet - vilket bekräftar adekvat cellvidhäftning.
Biofunktionaliseringsstudier – undersöker ytbiokompatibilitet in vitro
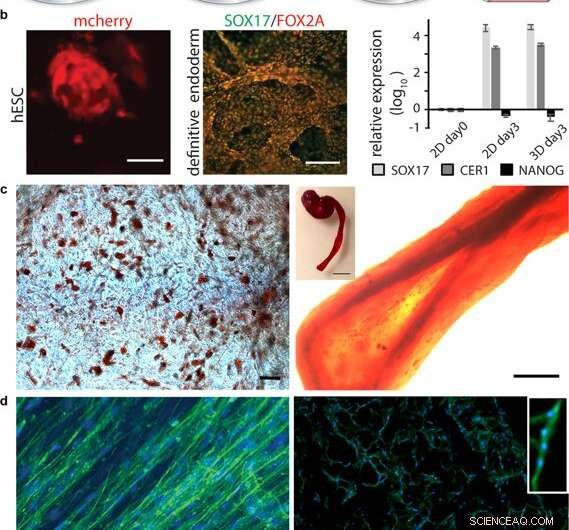
Differentiering av celler i 3D-silke. (a) Efter initial expansion av stamceller integrerade med 3D-silke, differentiering till olika vävnadstyper kan utlösas genom tillägg av lämpliga faktorer. (b) Differentiering av pluripotenta stamceller. Till vänster:Humana embryonala stamceller (hESC) visualiserade genom mCherry-detektion vid 48 h efter cellintegrering i FN-silkesskum. Skalstång = 50 µm. Mitten:Immunfärgning för endodermala markörer SOX17 (grön) och FOX2A (röd) efter 3 dagars differentiering. Skalstaplar = 200 µm. Höger:Genuttryck (SOX17, CER1, NANOG) av hESC i ett FN-silkeskum jämfört med 2D-kultur, analyserades med RT-qPCR vid dag 3 av endodermal induktion. Staplar representerar den genomsnittliga veckändringen ± standardavvikelsen (n = 4). (c) Differentiering av multipotenta vuxna stamceller. Till vänster:Humana mesenkymala stamceller (HMSC) i FN-silkesskum differentierade till den adipogena linage som innehåller lipider, visualiseras med röd oljefärgning (röd) (N = 2, n = 4). Skalstång = 100 µm. Höger:HMSCs differentierade till osteogena linage, sonderad med osteogen markör för kalciumhalt (Alizarin Red S (röd) i FN-silkesfiber (höger, skala bar = 200 µm), (N = 2, n = 4). Infällt visar foto av en hel fiber (höger), skalstång = 1 mm). (d) Differentiering av vuxna prekursorceller. Vänster:Efter 14 dagar i differentieringsmedia, skelettmuskelsatellitceller (HSkMSC) i en FN-silkesfiber visar framträdande aktinfilament, som visualiseras av falloidinfärgning (grön). Höger:Myogen differentiering av skelettmuskelsatellitceller (HSkMSC) visualiserad med Desmin-färgning (grön). DAPI-färgade kärnor i blått. (N = 9, n = 4). Skalstaplar = 200 µm. En närbild av området för ett myotub med flera kärnor visas i det övre högra hörnet. Kredit:Scientific Reports, doi:10.1038/s41598-019-42541-y
Efter att ha etablerat biomekanisk stabilitet, forskarna testade om stamcellerna som växte på sidenställningarna kunde differentiera (mogna) på samma material. För detta, de använde pluripotenta och multipotenta mänskliga embryonala stamceller i cellodlingsanalyserna, följt av kvantifiering av genuttryck av biologiska markörer för celltillväxt; FOXA2 (metaboliska gener), SOX17 (gener för embryonal utveckling och cellödebestämning), CER1 (benmorfogenetiska proteinantagonister) och NANOG (embryonal stamcellsproliferation, pluripotens och förnyelse). I resultaten, både SOX17 och CER1 visade robust uppreglering, medan biomarkören för pluripotens (NANOG) minskade på grund av cellmognad som ett resultat av förlusten av pluripotens.
Forskarna testade ytbiofunktionalisering för olika celltyper, inklusive mänskliga skelettmuskelsatellitceller (HSkMSC) och benmärgshärledda mänskliga mesenkymala stamceller (hMSC). Efter cellexpansion på konstruktionerna, forskarna kunde styra hMSC:s öde till antingen adipogena eller osteogena celllinjer. Dessutom, efter två veckors cellodling, Johansson et al. visade myogen differentiering av HSkMSCs för att bilda framträdande aktinfilament, och uttrycker den muskelspecifika markören desmin, för att verifiera in vitro myotubmognad.
Konstruera biologiska kärl i labbet
Forskarna kombinerade sedan endotelceller i det 3-D vaskulära nätverket för att bilda bindväv som efterliknade den inneboende cellulära organisationen av mikrokärl i labbet. De följde samma protokoll med silkesmontering med cellintegration och lade till en bråkdel av endotelceller för att konstruera bindväven. Om två veckor, de observerade cellerna samlas och bilda millimeter långa grenade groddar och kärlliknande strukturer med framträdande ringar av endotelceller i silkesfibrerna. Forskarna kunde öka storleken på konstruktionerna i skala och bestämma anpassningen och aggregeringen av olika celltyper.
På det här sättet, Johansson och Widhe m.fl. demonstrerade en ny strategi och utvecklade ett protokoll för att passa in i funktionella celler inom 3-D-nätverk som efterliknade den fibrösa arkitekturen hos den naturliga extracellulära matrisen (ECM). För att förmedla experimentet, de använde självmonterande rekombinanta sidenproteiner och visade att en mängd olika celler kunde bäddas in i 3D-konstruktionerna. Installationen och protokollet är enkla och kostnadseffektiva, till skillnad från 3-D-utskrift är processen sparsam och praktisk, utan dyra maskiner. Forskarna strävar efter att optimera och standardisera detta protokoll för att utveckla biokompatibla, avancerade sidenmaterial inom tissueteknik. Det experimentella arbetet kommer att ha ett brett spektrum av tillämpningar inom materialvetenskap som miniatyr in vitro-modeller för läkemedelsutveckling och som större biokonstruerade vävnadskonstruktioner inom regenerativ medicin.
© 2019 Science X Network