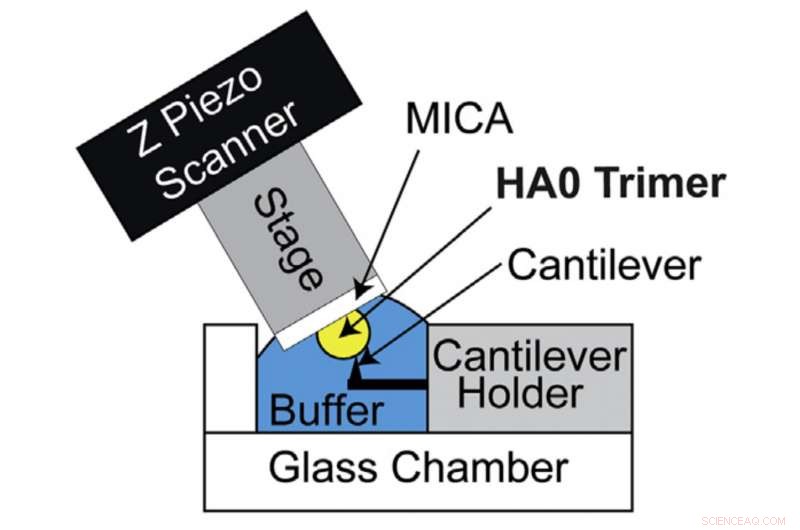
HS-AFM-inställning för direkt visualisering av HA0-trimer. Schematiskt diagram över HS-AFM-inställningen för skanning av HA0-trimern. Upphovsman:Kanazawa University
Influensa A -virus, som är ansvariga för dödliga pandemier tidigare, fortfarande ett stort globalt folkhälsoproblem idag. Molekyler som kallas virulensfaktorer produceras av bakterier, virus, och svampar som hjälper dem att infektera värdceller. En av virulensfaktorer som finns i influensa A -virus är hemagglutinin (HA). Forskare vid Kanazawa University har nyligen studerat strukturen för HA av aviär influensavirus, H5N1, med hjälp av höghastighets atomkraftmikroskopi (HS-AFM). Deras resultat är avgörande för att utveckla terapeutiska tillvägagångssätt mot influensa A -virus i framtiden.
HA syntetiseras initialt av värdceller i sin prekursorform som kallas HA0. Omvandling av HA0 till HA beror på patogeniciteten hos influensa A -virus:extracellulär omvandling för lågpatogen influensa A -virus och intracellulär omvandling för mycket patogena influensa A -virus. Därför, Att förstå strukturen och egenskaperna hos HA0 är av största vikt för att dechiffrera HA. Richard Wong och hans forskargrupp försökte därför granska HA0 under mikroskopet. Det rekombinanta HA0-proteinet av H5N1 analyserades visuellt med HS-AFM-systemet utvecklat av Kanazawa University.
Både HA0 och HA finns i homotrimeriska former och omvandling av HA0 till HA ändrar inte signifikant den homotrimeriska strukturen. Därför, det är rimligt att använda HA som mall för att generera HA0 HS-AFM-simuleringsbilder. En sur endosomal miljö är den kritiska faktorn för HA att inducera fusion mellan det virala membranet och det endosomala membranet för att frigöra virala material till värdceller. För att belysa den sura effekten på HA0, den utsattes först för en sur miljö. Trimern av HA0 visade sig vara mycket känslig för den sura lösningen och expanderade avsevärt. När konformationsförändringar av hemagglutinin mättes i realtid med HS-AFM, laget fann att området var större, och dess höjd kortare. Den sura miljön gjorde i huvudsak molekylen plattare och mer cirkulär, jämfört med den ursprungliga motsvarigheten. Denna förändring i konformation var, dock, vändbar när strukturen återvände till sin ursprungliga form vid neutralisering.
Denna studie banade väg för undersökning av biologiska händelser inom virus i realtid. Författarna uppger betydelsen av HS-AFM för denna forskning:"Vårt pilotarbete etablerar HS-AFM som ett oändligt verktyg för att direkt studera viral proteindynamik, som är svåra att fånga med låg signal-till-brusteknik som är beroende av ensemble-medelvärde, såsom cyro-EM och röntgenkristallografi, "säger huvudförfattare till studien Dr. Kee Siang Lim." Med hög skanningshastighet och en minimalt invasiv cantilever, vi förutsäger att HS-AFM är möjligt att avslöja flödet av irreversibla konformationsförändringar av HA2 inducerade av lågt pH, som efterliknar de sanna biologiska händelserna som inträffar när HA kommer in i en värdendosom, i framtida studier. "