
Sooyeon Hwang (sitter), Dong Su (vänster, stående, och Shuang Li vid Brookhaven Labs Center for Functional Nanomaterials, där de använde elektronmikroskop för att se hur kristallstrukturen och den kemiska naturen hos en batterielektrod gjord av ett järnoxidmaterial som kallas magnetit utvecklades när litium sattes in och extraherades över 100 laddnings- och urladdningscykler. Kredit:Brookhaven National Laboratory
På grund av deras höga energilagringstäthet, material som metalloxider, sulfider, och fluorider är lovande elektrodmaterial för litiumjonbatterier i elfordon och annan teknik. Dock, deras kapacitet avtar mycket snabbt. Nu, forskare som studerar en elektrod gjord av ett billigt och ogiftigt järnoxidmaterial som kallas magnetit har föreslagit ett scenario – beskrivet i onlinenumret den 20 maj av Naturkommunikation – Det förklarar varför.
"Magnetit, bland andra elektrodmaterial av konverteringstyp (dvs. material som omvandlas till helt nya produkter när de reagerar med litium), kan lagra mer energi än dagens elektrodmaterial eftersom de kan ta emot fler litiumjoner, " sa studieledaren Dong Su, ledare för Electron Microscopy Group vid Center for Functional Nanomaterials (CFN)—en US Department of Energy (DOE) Office of Science User Facility vid Brookhaven National Laboratory. "Dock, kapaciteten hos dessa material försämras mycket snabbt och är beroende av strömtätheten. Till exempel, våra elektrokemiska tester av magnetit visade att dess kapacitet sjunker mycket snabbt inom de första 10 höghastighetsladdnings- och urladdningscyklerna."
För att ta reda på vad som ligger bakom denna dåliga cykelstabilitet, forskarna karakteriserade hur magnetitens kristallstruktur och kemiska natur utvecklades när batteriet genomförde 100 cykler. För dessa karakteriseringsstudier, de kombinerade transmissionselektronmikroskopi (TEM) vid CFN och synkrotronröntgenabsorptionsspektroskopi (XAS) vid Advanced Photon Source (APS) - en DOE Office of Science User Facility vid Argonne National Lab. I TEM, en elektronstråle sänds genom ett prov för att producera en bild eller ett diffraktionsmönster som är karakteristiskt för materialets struktur; XAS använder istället en röntgenstråle för att undersöka materialets kemi.
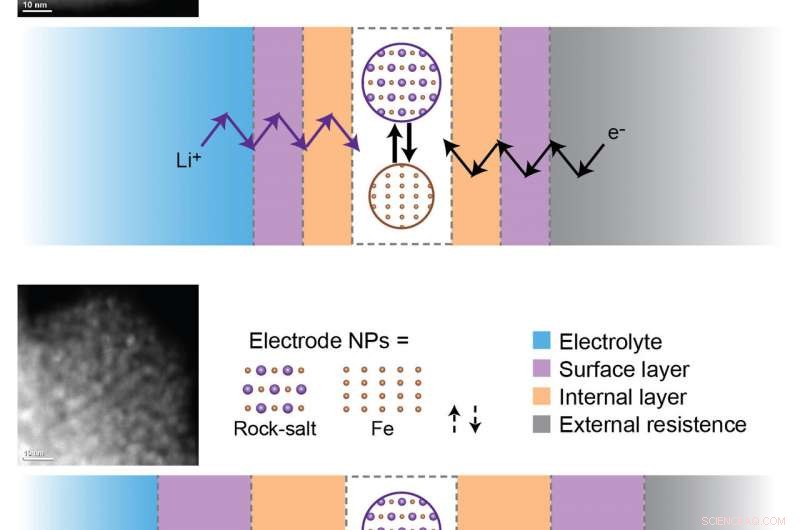
Minskningen av batterikapaciteten beror på bildandet och förtjockningen av inre och ytpassiveringsskikt under laddnings- och urladdningscykler. För att de elektrokemiska reaktionerna ska inträffa, litiumjoner (Li+) och elektroner (e-) måste färdas genom alla dessa lager för att nå aktiva nanopartiklar (NP) vid elektroden. Överst:Fe3O4 (järnoxid) prov efter tre cykler. Nederst:Fe3O4-prov efter 100 cykler. Utvecklingen av kinetiska barriärer under långvarig cykling begränsar elektrokemiska reaktioner till en sådan grad att inga reduktions-oxidationsreaktioner inträffar vid elektrodmaterialen efter 100 cykler. Kredit:Brookhaven National Laboratory
Genom att använda dessa tekniker, forskarna upptäckte att magnetit helt sönderdelas till metalliska järnnanopartiklar och litiumoxid under den första urladdningen. I följande åtal, denna omvandlingsreaktion är inte helt reversibel – rester av metalliskt järn och litiumoxid finns kvar. Dessutom, den ursprungliga "spinell"-strukturen av magnetit utvecklas till en "stensalt"-struktur (platsen för järnatomer är inte helt identisk i de två strukturerna) i det laddade tillståndet. Med efterföljande laddnings- och urladdningscykler, stensalt järnoxid interagerar med litium för att bilda en komposit av litiumoxid och metalliska järnnanopartiklar. Eftersom omvandlingsreaktionen inte är helt reversibel, dessa restprodukter ackumuleras. Forskarna fann också att elektrolyten (det kemiska mediet som gör att litiumjoner kan flöda mellan de två elektroderna) sönderdelas i senare cykler.
"Våra TEM-studier i realtid i ultrahögt vakuum gjorde det möjligt för oss att se hur strukturen hos stensaltjärnoxid förändras när litium introduceras efter de första cyklerna, ", sade Su. "Denna studie representerar unikt lithieringen in situ av ett precycled prov. Tidigare in situ-studier tittade bara på de initiala laddnings- och urladdningscyklerna. Dock, vi behöver veta vad som händer under många cykler för att designa batterier som håller längre eftersom strukturen vid den laddade elektroden är annorlunda än den i det orörda tillståndet."
På grundval av deras resultat, forskarna föreslog en förklaring till kapacitetsminskningen.
"Eftersom litiumoxid har en låg elektronisk konduktivitet, dess ackumulering skapar en barriär för elektronerna som pendlar fram och tillbaka mellan batteriets positiva och negativa elektrod, " förklarade den medledande författaren Sooyeon Hwang, en stabsforskare i CFN Electron Microscopy Group. "Vi kallar denna barriär för ett internt passiveringsskikt. På samma sätt, elektrolytisk nedbrytning hindrar jonledning genom att bilda ett ytpassiveringsskikt. Denna ansamling av hinder blockerar elektroner och litiumjoner från att nå aktiva elektrodmaterial, där de elektrokemiska reaktionerna inträffar."
Forskarna noterade att drift av batteriet vid låg ström kan återvinna en del av denna kapacitet genom att sakta ner laddningshastigheten för att ge tillräckligt med tid för elektrontransport; dock, andra lösningar behövs för att i slutändan lösa problemet. De tror att tillsats av andra element till elektrodmaterialet och byte av elektrolyten kan förbättra kapacitetsblekningen.
"Kunskapen vi fått kan generellt tillämpas på andra omvandlingsföreningar, som också möter samma problem med interna och externa passiveringsskikt, " sa medkorrespondent författare Zhongwei Chen, professor vid University of Waterloo, Kanada. "Vi hoppas att denna studie kan hjälpa till att vägleda framtida grundläggande forskning om dessa lovande elektrodmaterial av konverteringstyp."