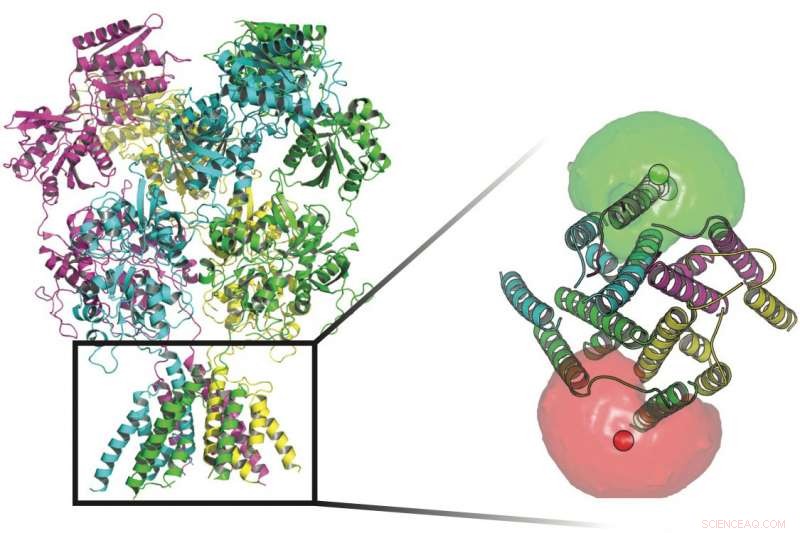
Forskare vid Rice University och UTHealth spårade konformationerna av proteiner som står vakt vid transmembrankanaler i nervcellers väggar. Vid basen av proteinerna i den här bilden finns fluoroforer (röda och gröna sfärer) omgivna av fluoroformoln som hjälpte forskarna att definiera rörelserna hos porten som tillåter joner att flöda genom membranet. Kredit:Rice University/UTHealth
Förmågan att spåra enskilda molekylers rörelser har avslöjat hur proteiner på nervcellers yta styr grindar som förvandlar kemiska signaler till elektriska signaler. Fyndet är ett steg framåt i att detaljera mekanismer involverade i neurologiska sjukdomar, enligt forskare vid Rice University och University of Texas Health Science Center i Houston (UTHealth).
Med hjälp av sofistikerad bildbehandling och statistiska metoder, forskarna använde en molekyl FRET-avbildningstekniker för att etablera ett strandhuvud vid NMDA-receptorporten som, när den är aktiverad, låter joner flöda genom nervcellens membran.
FRET står för Förster resonance energy transfer. Det är ett sätt att använda ljuset som emitteras av två fluorescensmärkta molekyler som en känslig linjal för mycket små avstånd, såsom öppningen i NMDA-receptorkanalen.
Riskemist Christy Landes, en expert på enmolekylär FRET, och Vasanthi Jayaraman, en professor i biokemi och molekylärbiologi vid UTHealths McGovern Medical School, vars expertis är inom NMDA-receptorbiokemi, samarbetade för att samla de första experimentella bevisen som beskriver dynamiken i hur receptorerna ändrar sina former för att kontrollera portens känslighet för kemiska signaler. Den nya studien dyker upp i Naturens kemiska biologi .
NMDA-receptorn består av fyra proteinsubenheter, var och en med fyra domäner, och var och en av dessa domäner har en speciell funktion. Kollektivt, de spänner över cellmembranet. Varje underenhet kan ha många "tillstånd, " eller former, som reglerar vilka elektriska signaler – och hur många av dem – som passerar. Underenheterna sitter på varje sida av kanalen och aktiveras när de binder både glutamat- och glycin-neurotransmittorligander och triggar signalvägen som tillåter positivt laddade joner att passera in i cellen.
"Dessa receptorer är avgörande för normal fysiologisk funktion, " Jayaraman sa. "Många gånger kanske du inte vill slå på eller stänga av signalering. Du kanske vill slå in omfattningen av signaleringen. När vi väl förstår alla proteinets tillstånd, vi kan börja fundera på sätt att göra detta, håller alltså proteinet aktivt men i varierande grad efter behov.
"Det är viktigt för läkemedelsutveckling att förstå denna dynamik eftersom rörelserna och de energetiska egenskaperna hos dessa proteiner dikterar deras specifika funktioner, sa hon. Vi kunde göra båda.
Denna kunskap kan leda till multifunktionella läkemedel som påverkar kanalerna på subtila sätt, sa Landes. Kända NMDA-receptorantagonister inkluderar vanliga anestetika, syntetiska opioider som metadon och dissociativa läkemedel som ketamin och dikväveoxid. Deprimerad NMDA-receptorfunktion misstänks vid minnesbrist som vanligtvis förknippas med åldrande. Alkohol är känt för att hämma glutamat, en av två signalsubstanser som binder till NMDA.

De fyra underenheterna av NMDA-receptorproteiner kan var och en ha många tillstånd som reglerar vilka elektriska signaler som passerar genom membranet i en nervcell. Underenheterna aktiveras när de binder både glutamat- och glycin-neurotransmittorligander och triggar signalvägen som tillåter positivt laddade joner att passera in i cellen. Kredit:Rice University/UTHealth
"Många läkemedelsdesign har som kärnprincip att det finns ett sätt att binda, och du sätter i princip antingen på eller stänger av något, ", sa Landes. "Men det är uppenbart att den här typen av receptorprotein inte bara är på eller av. Det finns flera konformationella interaktioner som antingen förbättrar eller försämrar signaleringen."
I en tidigare studie, teamet analyserade konformationerna av ett mindre och enklare men relaterat system, den C-clamp-liknande agonistbindande domänen av en annan receptor, AMPA. AMPA förmedlar snabb signalöverföring i centrala nervsystemet. FRET-tekniken med en molekyl gjorde det möjligt för forskarna att få de första ögonblicksbilderna av AMPA-proteinets olika klämkonformationer i vila och även när de var bundna till en rad målmolekyler genom att mäta avståndet mellan två ljusaktiverade molekylära taggar.
Den här gången, forskarna försökte förstå själva kanalöppningen – hur proteinerna som utgör NMDA-receptorkanalen rör sig för att aktivera jonporten. Genom att lägga till fluorescerande taggar över kanalen och ta prover över tid, de kunde kartlägga energilandskapet för proteinets transmembransegment i vilotillstånd eller under påverkan av ligander som modulerar porten bland öppna, slutna och mellanliggande tillstånd. Varje kanals strukturella tillstånd påverkar direkt de elektriska signalerna som tillåts passera.
De upptäckte att det agonistfria (vila) tillståndet är strukturellt stelt, vilket bekräftade dess energiska motstånd mot att anta konformationer som skulle tillåta kanalöppning. Agonister som glutamat är målkemikalierna som utlöser elektrisk signaltransport genom kanalen. Forskarna bekräftade att i närvaro av den primära agonisten, NMDA-kanalen var mindre styv och kunde därför övergå lättare mellan de möjliga kanalöppna konformationerna.
Arbetet visade också hur två modulatorer som är kända för att interagera med olika delar av den fulla receptorns kanalkonformation och styvhet. Zinkjoner, trots bindning till den extracellulära delen av receptorn långt borta från kanalen, inducera en styv kanal med betydande energiska hinder för öppning, liknande receptorns vilotillstånd. I kontrast, "porblockeraren" dizocilpin visade sig förbättra energin i övergångar mellan flera konformationer som inte relaterar till kanalöppning.
Landes sa att istället för att fånga statiska tillstånd, som vanligtvis görs med röntgenstrålar, "Vi tittade på avståndsförändringar över kanalen på ett dynamiskt sätt. Det är mycket mer komplicerat." Det gav dem en datauppsättning mer lik en film än en ögonblicksbild, Hon sa.
Hon sa att studien krävde nya tekniker för att rena och stabilisera de fulla proteinerna, som hämtades från nervceller hos gnagare. "Det var tre nyckeldelar till detta projekt:hantering av hela proteinerna, få dem renade och märkta på singelreceptornivå och utföra dataanalysen för att ta reda på vad det betyder.
"Det är verkligen grunden här, "Nu kan vi göra dessa mätningar för mycket mer komplicerade system."