
Ögonblicksbilder från en simulering som avslöjar mekanismen genom vilken hepatit C-virus helikas bryter dubbla DNA-strängar. De två motoriska domänerna går längs den övre strängen med hjälp av inchworm-translokationsmekanismen. De tredje domänerna fungerar som en kil som mekaniskt separerar duplexet (från fig. 14). Kredit:Kanazawa University
Den levande cellen kan ses som en fabrik där proteinmaskiner ansvarar för olika processer, såsom transport av material inuti cellen eller operationer med andra makromolekyler som DNA. Deras drift drivs vanligtvis av ATP-molekyler, den största energibäraren i biologiska celler. Den kemiska energin som erhålls genom ATP-hydrolys används av en proteinmaskin för att cykliskt ändra sin form och därmed utföra en viss funktion. Därav, att lösa funktionella konformationsförändringar i proteiner är en stor utmaning, med grundläggande betydelse för förståelse och kontroll av biologiska enmolekylära motorer och maskiner.
Komplexiteten i interaktioner mellan atomer i en proteinmaskin är så hög att inte ens världens bästa superdatorer kan återskapa bara en av sina operationscykler. I denna recensionsartikel, det har dock visat sig att väsentliga aspekter av driften av sådana naturliga nanoenheter redan kan avslöjas genom att utforska mycket enkla mekaniska modeller av proteiner, d.v.s. genom att behandla sådana makromolekyler som elastiska nätverk erhållna genom att förbinda partiklar med en uppsättning elastiska fjädrar.
Författarna, professor Alexander Mikhailov och biträdande professor Holger Flechsig från Nano Life Science Institute vid Kanazawa University i Japan, hävdar att elastiska nätverk som motsvarar proteinmaskiner med funktionell dynamik har speciella egenskaper, uppstod i den biologiska evolutionsprocessen. Trots en uppenbar komplexitet, interna rörelser i sådana system fortskrider på ett ordnat sätt, som om den leddes längs dolda järnvägsspår. Således, en molekylär maskin beter sig likt makroskopiska mekaniska enheter med mycket koordinerade rörelser av deras delar. Detta säkerställer att den cellulära fabriken kan fungera robust trots kraftiga fluktuationer på nanoskala.
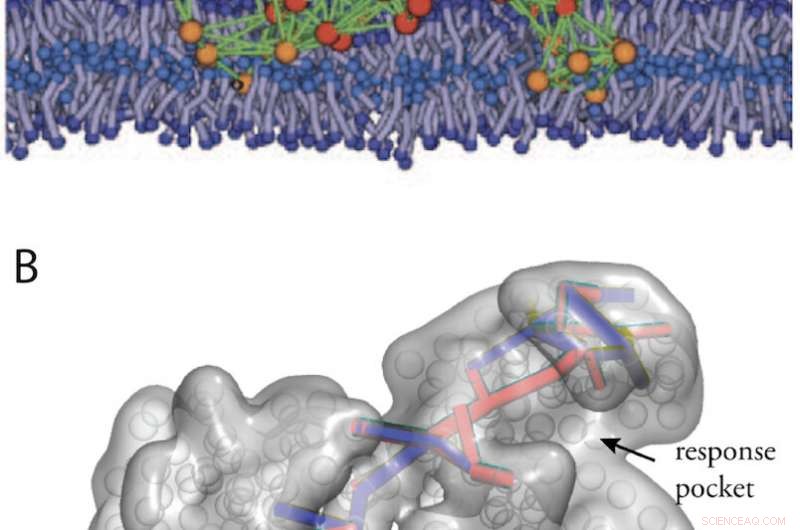
Konstgjorda proteinliknande strukturer erhållna genom in silico Evolution. (A) En modell av proteinmaskin i ett biologiskt membran (från fig. 11). (B) Kommunikationsvägar i en designad allosterisk struktur (från ref. 34). Kredit:Kanazawa University
Genom att använda detta tillvägagångssätt, simuleringar som täcker hela operationscykler kunde utföras och de första molekylära filmerna av proteinmaskiner erhölls på så sätt. Som ett exempel, Fig. 1 från författarnas ursprungliga publikation från 2010 visar hur det motoriska helikasproteinet från hepatit C-viruset – en huvuddel av dess replikationsmaskineri och ett viktigt farmakologiskt mål för antivirala läkemedel – aktivt rör sig längs DNA:t och mekaniskt öppnar det.
Konstgjorda proteinliknande strukturer med maskinegenskaper skulle dessutom kunna designas genom att köra en datorutveckling av elastiska nätverk. I fig. 2 visas två exempel, en designad modellmaskin som arbetar inom ett biologiskt membran, och en maskin som uppvisar allosterisk kommunikation.
Den här översiktsartikeln presenterar ett nytt perspektiv i förståelsen av biologiska cellers komplexa maskineri. Det banar också vägen för nya tillvägagångssätt i designen av konstgjorda nanomaskiner - en uppgift med stor potential för framtida biotekniska tillämpningar.