Illustration. Silver. Kredit:@tsarcyanide/MIPT
Forskare från Moskvainstitutet för fysik och teknik har slagit sig ihop med kollegor i Ryssland och Saudiarabien och föreslagit en effektiv metod för att få fram grundläggande data som är nödvändiga för att förstå kemiska och fysikaliska processer som involverar ämnen i gasform. Det föreslagna numeriska protokollet förutsäger den termiska effekten av gasfasbildning av silverföreningar och deras absoluta entropi. Detta inkluderar första sådana data någonsin för över 90 föreningar. Publicerad i tidskriften Oorganisk kemi , fynden är viktiga för praktiska tillämpningar av ämnen som innehåller silver, inklusive vid vatten- och sårdesinfektion, fotografering och molnsådd.
Teamet härledde de exakta värdena för bildningsentalpin och entropin för många silverföreningar. Entalpin (från grekiska "thalpein, " som betyder "att värma") av ett system beskriver dess tillstånd i termer av energin hos de ingående partiklarna, tryck och volym. Enligt Hess lag, multiplicering av stökiometriska koefficienter och skillnaden mellan reaktanternas och produkternas bildningsentalpier ger mängden värme som genereras eller förbrukas i en kemisk reaktion. Entropi är ett mått på hur oordnat ett system är. Termodynamikens andra lag säger att ett system spontant kan anta ett mindre organiserat tillstånd, så entropin ökar med tiden.
Att känna till värdena för entalpi och entropi är avgörande för att förutsäga om en reaktion någonsin kommer att inträffa under givna förhållanden. Dessa egenskaper indikerar också hur reaktionsutbyte och selektivitet - förhållandet mellan produkter - varierar med temperatur och tryck, möjliggör optimering. Resultaten gör det möjligt för forskare att göra förutsägelser om kemiska processer som sker i gasfasen. Uppgifterna kommer också att hjälpa till att hantera processerna involverade i tunnfilm och ren provavsättning från gasfasen.
Det finns i princip två sätt att bestämma entalpi- och entropiförändringar - antingen genom komplexa och kostsamma experiment, eller genom att använda data från referensböcker och göra lite aritmetik baserad på Hess lag.
"Valet verkar vara självklart, mer med tanke på att du inte experimentellt kan mäta värmen från vissa reaktioner, sa Yury Minenkov, senior forskare vid Laboratory of Supercomputing Methods in Condensed Matter Physics. "Till exempel, ofullständig grafitförbränning ger alltid både kolmonoxid och koldioxid. Så även genom att mäta reaktionens termiska effekt, vi kunde inte bestämma kolmonoxidbildningsentalpi.
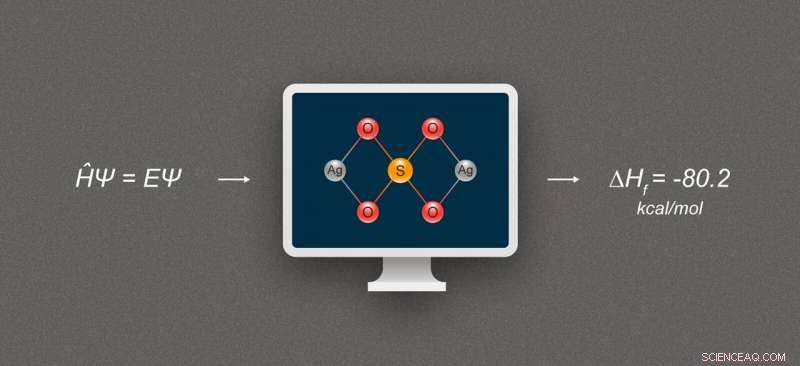
Figur 1. Förenklat diagram som illustrerar formationsentalpiberäkning för silverföreningar. Den avbildade föreningen är silversulfat, Ag2S04. Kredit:@tsarcyanide/MIPT
"Men beräkningsmetoden står inför vissa problem, Minenkov fortsatte. "Först, bildandets entalpier och entropier är inte kända för varje förening. Andra, även om uppgifterna är tillgängliga, ingen kan garantera deras noggrannhet. Värdena varierar stort mellan referensböcker. Ibland, Mätfelen kan vara ganska stora."
Lyckligtvis, kvantkemi hjälper till att erhålla entropin och, i viss utsträckning, entalpidata. Varje ingående molekyl i en gasformig substans kan ses som ett system av positivt laddade kärnor och negativt laddade elektroner. Forskare kan sedan tillämpa elektroniska strukturberäkningsmetoder för att lösa den molekylära Schrödinger-ekvationen. Detta avslöjar molekylens totala elektroniska energi, dess vågfunktion, och den rumsliga konfigurationen av kärnor - det vill säga, dess 3-D geometriska struktur. Fysiker kan sedan beräkna entropin och entalpin för en idealgas som består av sådana molekyler. De entropivärden som erhålls på detta sätt introduceras sedan i referensböcker och används i termodynamiska beräkningar.
Problemet med entalpi är att inte är ett grundläggande värde vid denna tidpunkt, det beror väsentligt på den valda metoden för Schrödinger-ekvationsberäkning.
Finfördelningsreaktioner används vanligtvis för att beräkna bildningsentalpin. I sådana reaktioner, föreningen av intresse bryts ner i individuella atomer. Till exempel, silversulfid—Ag 2 S — ger en svavel- och två silveratomer. Eftersom entalpierna för bildning av atomära ämnen är välkända och rapporteras i referensböcker, det är möjligt att beräkna entalpin för bildningen av det ursprungliga ämnet - i detta fall, silversulfid - genom att hitta entalpiförändringen i reaktionen via kvantkemimetoder.
Dock, när molekyler som består av många atomer genomgår finfördelning, detta påverkar den elektroniska strukturen i sådan utsträckning att entalpi, för, är väsentligt förändrat. De för närvarande tillgängliga metoderna för teoretisk kemi kan inte redogöra för dessa effekter med tillräcklig noggrannhet.
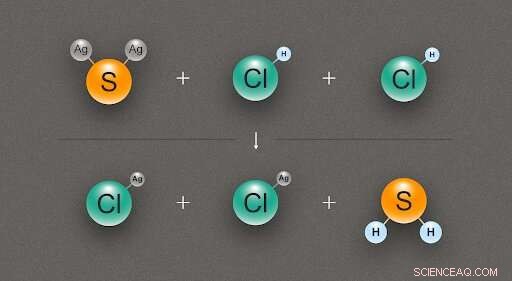
Figur 2. Ett diagram som illustrerar den kemiska reaktionen mellan en silversulfid (Ag2S) och två saltsyra (HCl) molekyler, producerar två molekyler av silverklorid (AgCl) och en av vätesulfid (H2S). Kredit:@tsarcyanide/MIPT
Teamet av forskare från MIPT, Frumkin Institute of Physical Chemistry and Electrochemistry vid den ryska vetenskapsakademin, Ivanovo State University of Chemistry and Technology, och Saudiarabiens kung Abdullah University of Science and Technology har publicerat en serie artiklar som föreslår ett sätt att beräkna de termodynamiska egenskaperna hos organiska och oorganiska föreningar med större noggrannhet.
När det gäller silversulfid, forskarna fann dess entalpi för bildning från reaktionen med saltsyra, vilket ger silverklorid och vätesulfid (fig. 2). Eftersom antalet obligationer i den översta raden är detsamma som i den nedre raden, energiförändringen kan beräknas med minsta fel.
Värmen från bildning av silverklorid, vätesulfid, och saltsyra är kända med hög noggrannhet, och datormodellering avslöjar reaktionens termiska effekt. Från dessa uppgifter, det är möjligt att härleda värmen från bildningen av silversulfid med hjälp av Hess lag.
"Den klassiska kopplade klustermetoden, känd som CCSD(T), är guldstandarden för att lösa den elektroniska Schrödinger-ekvationen inom modern kvantkemi, " Minenkov förklarade. "Vi ersatte den med den lokala versionen som heter DLPNO-CCSD(T), som utvecklades för inte så länge sedan vid Max Planck Institute. Detta krympte den erforderliga beräkningskraften med en storleksordning. Enligt den konventionella CCSD(T), beräkningstiden varierar med storleken N på molekylen som N 7 , så det är inte ett alternativ för stora molekyler. Den lokala versionen är mycket mindre tid- och resurskrävande."
Teamet började med att kontrollera hur väl resultaten av deras kvantkemiska beräkningar överensstämde med de experimentella termodynamiska och strukturella data. Referensböcker rapporterade värdena för 10 silverföreningar, och de var en bra match. Efter att ha säkerställt att deras modell är adekvat, forskarna beräknade de termodynamiska egenskaperna för 90 silverföreningar som saknas i böckerna. Datan är till nytta för både forskare som arbetar inom silverkemi och för att testa och kalibrera nya metoder för elektronisk strukturberäkning.