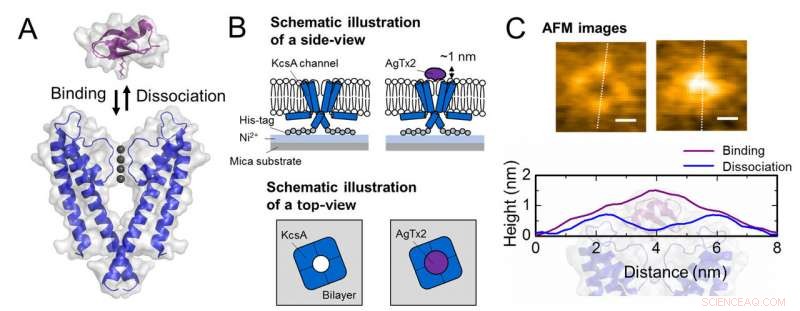
Schema för association och dissociation av kaliumkanal KcsA (Q58A/T61S/R64D) och AgTx2 och representativa AFM-bilder. A. Association (bindande) av KcsA och AgTx2. B. Schema som visar ett prov för AFM-observation.
C. Representativa AFM -bilder och med mått som visas som vita prickade linjer. Bar, 2 nm. Upphovsman:Kanazawa University
Agitoxin-2 (AgTx2) från skorpiongift är en potent blockerare av K+-kanaler. Forskare har nu observerat bindningsdynamiken hos AgTx2 till KcsA-kanalen med hjälp av höghastighets atomkraftsmikroskopi. Enmolekylära kinetiska analyser avslöjade att kanalens affinitet för AgTx2 ökade under ihållande bindning och minskade under ihållande dissociation. Forskarna föreslår en fyrtillståndsmodell med relevanta hastighetskonstanter. En inducerad passform var dominerande och accelererade bindningen 400 gånger.
Cellmembran innehåller jonkanaler som reglerar permeationen av olika joner mellan insidan och utsidan av cellen. Jonkanaler är proteiner, och som svar på olika stimuli, de tillåter specifika joner att tränga igenom. På så sätt reglerar cellen de elektriska signalerna som ligger till grund för musklernas och nervsystemets funktion. Eftersom en funktionsfel i jonkanalerna orsakar ett antal störningar som hjärtinfarkt och epilepsi, det är viktigt att förstå verkningsmekanismen för molekyler som hämmar jonkanalfunktioner.
Skorpiongift har visat sig innehålla mer än 200 föreningar som binder till K+-kanaler. Bland dem, AgTx2 är en peptid som består av 38 aminosyrarester. Tidigare studier visade att genom att binda till K+-kanalen från utanför cellmembranet, AgTx2 blockerar K+-kanalporen och hämmar K+-permeation. Dock, den detaljerade molekylära mekanismen förblev okänd, t.ex. huruvida bindningsdynamiken kunde förklaras av en tvåtillståndsmodell av association och dissociation.
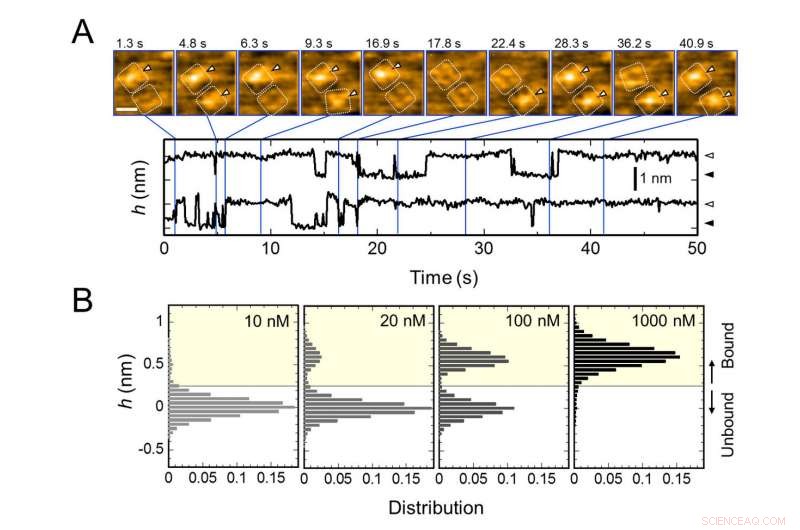
Upprepad bindning av AgTx2 till kaliumkanal KcsA och AgTx2 - koncentrationsberoende av bindningssannolikhet. A. Time-lapse-bilder av AgTx2-bindning till och dissociation från KcsA-kanalerna och tidsförlopp av medelhöjden (h) (nm) runt mitten av den extracellulära ytan. Skalstapel i HS-AFM-bilden, 5 nm. B. Höjdhistogram för h beroende på AgTx2-koncentrationen i lösningen. Upphovsman:Kanazawa University
Forskargruppen, inklusive forskare från Kanazawa University, visualiserade associationen och dissocieringen av AgTx2 med K+-kanalen KcsA med hjälp av höghastighets atomkraftsmikroskopi (HS-AFM) och utförde en detaljerad analys av dynamiken (Figur 1). KcsA är en tetramer, dess underenheter bildar en ringliknande struktur. Vid AgTx2 -bindning till tetramerytan, den centrala delen av kanalen, dvs passagen för K+, verkade svullen på grund av AgTx2-bindning. Bindningen och dissocieringen av AgTx2 till K+-kanalen kunde ske upprepade gånger och höjden runt kanalens centrum ändrades i enlighet med detta (Figur 2).
När AgTx2 -koncentrationen i lösningen var hög, bindningssannolikheten var också hög. Tidsförlopp för bindningen och dissociationen visade att vid bindning av AgTx2 till KcsA, konformationen av KcsA förändrades, vilket möjliggjorde AgTx2-bindning lättare, och att även vid dissociering av AgTx2, en annan AgTx2-molekyl kunde binda till KcsA mycket snabbt; detta kallas en inducerad passningsmekanism. Å andra sidan, det observerades att, när tillräcklig tid förflutit efter AgTx2-dissociation, konformationen av KcsA ändrades tillbaka till originalet, till vilken AgTx2 band mindre lätt.
Dessa resultat indikerar att bindningsdynamiken inte kan förklaras med en enkel tvåtillståndsmodell, dvs bindning och dissociation. Det verkade som om både associations- och dissociationstillstånden för KcsA kunde särskiljas som åtminstone två delstater; Därför övervägdes en modell med fyra stater (Figur 3). När reaktionshastigheterna beräknades för en fyrstatsmodell återspeglade de erhållna hastigheterna som erhållits experimentellt. En simulering av bindningsdynamiken med denna fyrtillståndsmodell och de associerade reaktionshastigheterna, visade att AgTx2-bindning huvudsakligen skedde via den inducerade passningsvägen. Ytterligare, det visade sig att den inducerade passningen accelererade AgTx2-bindningen 400 gånger. Således, mekanismen för AgTx2 för att effektivt hämma funktionen av KcsA har klarlagts (Figur 3).
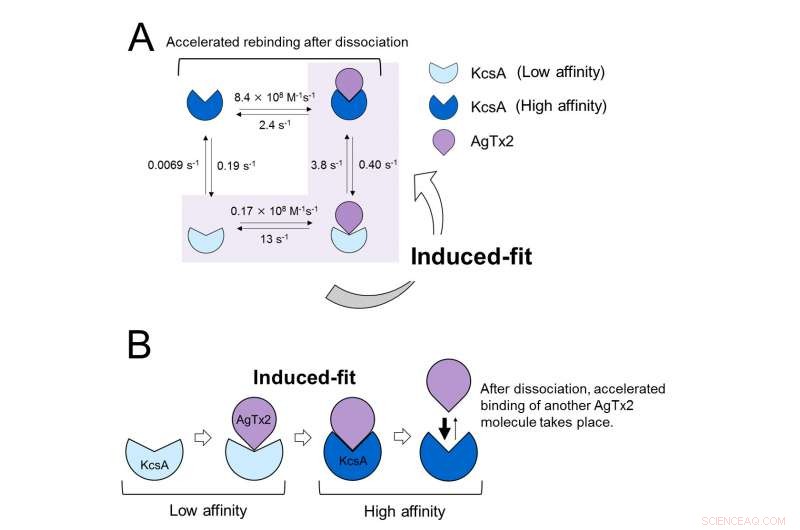
Bindningsdynamikmodell av AgTx2 och kaliumkanal KcsA. A. Hastighetskonstanter för reaktionsstegen. B. Accelererad bindning av AgTx2 till kaliumkanal KcsA genom inducerad passningsmekanism. Upphovsman:Kanazawa University
HS-AFM-observationstekniken och metoden som används för analys av bindning av K+-kanalen och peptidinhibitorn kan tillämpas på en mängd olika biologiska molekyler. De kan tillämpas på analyser av en ligand som binder till dess receptor såväl som association av DNA och ett DNA-bindande protein. Denna studie förväntas påskynda klargörandet av bindningsdynamiken för olika biologiska molekyler.
Studien publiceras i Vetenskapens framsteg .