FESS design motivering, genomförande, och ansökan. (A) Schematisk övergångsväg för biomarkörinformation som aktiveras av FESS, illustrerar provtagning, avkänning, och dirigering av epidermalt hämtad biomarkörinformation till avläsningselektronik genom en enda enhet. (B) Designrationalen för FESS. (C) Representativt genomförande av FESS, uppvisar flexibilitet och ingen sammankoppling i planet. (D) Representativ familj av FESS-enheter, som innehåller 1 × 2, 3 × 3, och 6 × 6 elektroduppsättningar. (E) Specialutvecklad och FESS-aktiverad smartklocka för övervakning av biomarkörer. (F och G) Utplacering av den FESS-aktiverade smartwatchen i stationära (F) och högintensiva träningsinställningar (G). (Fotokredit:Peterson Nguyen, Kaili Chiu, Yichao Zhao, University of California, Los Angeles.) Kredit: Vetenskapens framsteg , doi:10.1126/sciadv.aaz0007
I en ny studie publicerad på Vetenskapens framsteg , Yichao Zhao och ett forskarteam inom integrerad bioelektronik och material och ingenjörskonst i USA konstruerade en engångsprodukt, fristående elektrokemiskt avkänningssystem (FESS). FESS gjorde det möjligt för dem att förverkliga en designstrategi på systemnivå för att möta utmaningarna med bärbara biosensorer i närvaro av rörelse och möjliggöra sömlös integration med konsumentelektronik. Teamet utvecklade en FESS-aktiverad smartklocka, med svettprov, elektrokemisk avkänning och datavisning eller överföring, inom en fristående bärbar plattform. Teamet använde FESS-smartwatch för att övervaka profilerna för svettmetaboliter bland individer i stillasittande och högintensiv träning.
Internet-of-things-infrastrukturen (IOT) kan användas i bärbar konsumentelektronik för att förvandla personlig och precisionsmedicin genom att skörda fysiologiskt relevant data med minimalt användaringripande. Forskare har vanligtvis använt fysiska sensorer i kommersiella bärbara plattformar för att spåra en användares fysiska aktivitet och vitala tecken. Dock, att få insikt i kroppens dynamiska kemi, forskare kräver elektrokemiska avkänningsytor för att rikta biomarkörmolekylerna i icke-invasivt hämtade kroppsvätskor som svett. För att åstadkomma detta, det är avgörande att exakt konstruera informationsleveransvägen från huden till en avläsningsenhet. För elektrokemisk avkänning, informationsleveransvägen måste ta prov och leverera den biomarkörrika biovätskan till sensorytan i en mikrofluidisk struktur, följt av signalöverföring genom sammankopplade element till avläsningselektroniken. Signalen måste upprätthållas längs denna väg i närvaro av rörelseinducerad belastning.
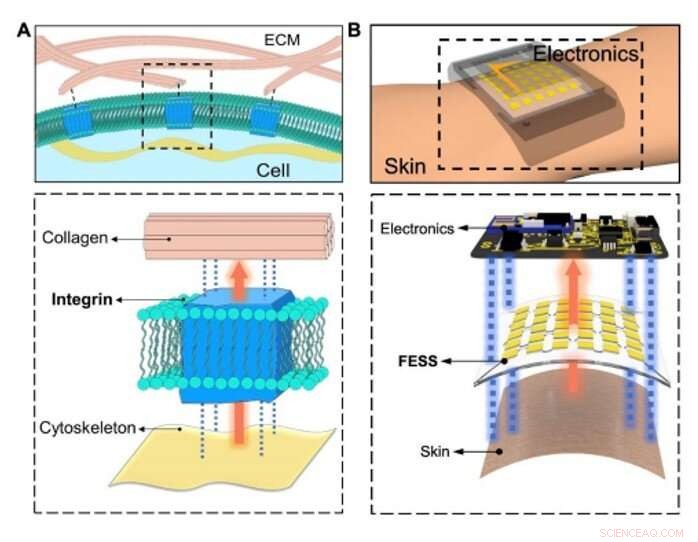
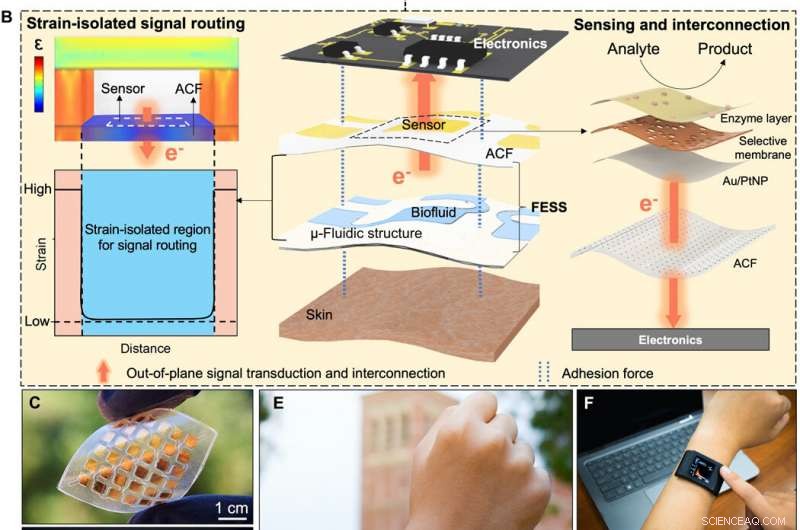
Bioinspirerad in situ-avkänning och signalsammankoppling. (A) Konceptuell illustration av det fysiologiska informationsutbytet mellan intracellulära/extracellulära matriser som underlättas av celladhesiva molekyler (integrin) via avkänning, signalsammankoppling utanför planet, och dubbelsidig vidhäftning. (B) Avkänning på plats, signalsammankoppling utanför planet, och dubbelsidig vidhäftning som möjliggörs av FESS, som en enda enhet, placeras mellan hud och elektronik. Kredit:Science Advances, doi:10.1126/sciadv.aaz0007
I det här arbetet, Zhao et al. utvecklade det fristående elektrokemiska avkänningssystemet (FESS) och fäste det samtidigt på huden och på elektroniken med hjälp av dubbelsidiga vidhäftningskrafter utan stela kopplingar. FESS tog prov och riktade epidermalt hämtade biovätskor för elektrokemisk avkänning, följt av routing till avläsningselektronik genom en töjningsisolerad väg. De integrerade FESS inuti en specialbyggd smartklocka för svettinduktion, provtagning, elektrokemisk avkänning, signalbehandling och datavisning eller överföring. Resultaten visade högfientlig signaltransduktion och robust mekanisk kontakt med mänsklig hud utan att begränsa användarens rörelser. Det fristående avkänningssystemet kan kopplas till framtida bärbar elektronik för att generera högtrogna hälso- och friskvårdsrelaterade datauppsättningar baserat på användarnas dagliga aktiviteter.
För att skapa en effektiv biologisk väg, Zhao et al. valt integrin – en celladhesiv molekyl som effektivt möjliggjorde fysiologiskt informationsutbyte mellan intracellulära och extracellulära matriser. FESS-enheten implementerade integrinliknande funktioner genom en stamisolerad region i en mikrofluidisk struktur. De konstruerade FESS som en vertikalt ledande, dubbelsidigt självhäftande och flexibelt mikrofluidiskt bioanalytiskt tunnfilmssystem som består av flera vertikalt staplade filmer. Dessa filmer inkluderade en adhesiv anisotropisk ledande film (ACF), en elektroduppsättningsfilm av ädelmetall, en biokemisk film, en mikrofluidisk film och en hudadhesiv film. De tejpade det kompletta tunnfilmssystemet på avläsningselektroniken utan kontakter och med minimalt kontaktmotstånd för att potentiellt omvandla alla elektriska kontakter till en kemisk eller biologisk sensor. Teamet utvecklade ett proof-of-princip, fristående biomarköravkännande smartklocka med FESS för att övervaka svettmetabolitprofilerna hos individer i stillasittande kontra högträning.

FESS töjningssimulering och karakterisering av töjningsisolerad signalsammankoppling. (A) Illustration av FESS:s signalkoppling utanför planet jämfört med konventionell signalkoppling i planet. Konventionella implementeringar är begränsade till signaldirigering genom mycket ansträngda regioner, medan den utarbetade FESS möjliggör routing via nära-noll töjningsregioner. (B) COMSOL-simulerad töjningsprofil (ε) för en representativ FESS i närvaro av en externt applicerad skjuvkraft, illustrerar nästan noll töjning i botten av mikrokanalen (dvs. gränssnitt mellan substrat och biovätska). (C) Motsvarande inzoomad vy av töjningsprofilen för en "pixel". (D) Töjningsfördelning längs den streckade linjen i (C). (E) Elektrisk karakterisering av FESS för sammankoppling utanför planet utförd under olika lokaliserade böjningsvinklar (för en matris med 6 × 6 Au-elektroder). (F) Sammankopplingsmotstånd för den böjda FESS-FPCB (RFESS + RFPCB), för olika lokala böjningsvinklar (normaliserad med avseende på RFPCB utan böjning, RFPCB, 0). Felstaplar indikerar standardfel för mätningar över de sex elektroderna inom varje kolumn. (G) Resistansmätningar av FESS-elektroderna under olika böjningsvinklar (n =36), i förhållande till FPCB-kontaktdysens motstånd (RFPCB, 0). (H till J) 180° avskalningstest som karakteriserar sammankopplingsvidhäftningen mellan PCB och FESS med olika stödstrukturer:mikrofluidisk bas–ACF (H), mikrofluidkanal – ACF (I), och en representativ mikrofluidkanal-array-ACF (J). (Fotokredit:Peterson Nguyen, University of California, Los Angeles.) Kredit: Vetenskapens framsteg , doi:10.1126/sciadv.aaz0007
I denna inställning, den vertikala konduktiviteten hos ACF underlättade signalförbindelser utanför planet för att undvika oönskade kroppsrörelseinducerade påkänningseffekter på signalvägarna. Teamet karakteriserade den mekaniska vidhäftningsegenskapen hos FESS för att säkerställa att vidhäftningskrafterna mellan FESS och elektronik var högre än mellan FESS och torr eller aktivt svettig hud. Teamet testade kraften som krävs för att dra ACF-lagret från FESS på ett kretskort och resultaten visade en stark FESS-baserad sammankoppling till elektronik, som lämpar sig för applikationer på kroppen.
Zhao et al. testade sedan signaltransduktionsförmågan hos FESS. De mönstrade ädelmetallelektroder på ACF för att uppnå biokemisk-till-elektrisk signaltransduktion, följt av deponering av biokemiska filmer för att analysera biomolekylära mål av intresse. De testade den elektrokemiska aktiviteten hos metallmönstrad ACF för två vanligt använda elektrodytor på omodifierat guld (Au) och platina (Pt) nanopartikelmodifierat Au. De elektroanalytiska metoderna som undersöktes i arbetet gav prov-till-svar biomarköravläsningar för att få realtidsinsikt i förändringarna i svettbiosammansättningen.

Testning av motståndsmätningen av ACF-baserade sammankopplingar efter mekanisk deformation. Kredit:Science Advances, doi:10.1126/sciadv.aaz0007
I de kommande experimenten, forskargruppen visade FESS förmåga att övervaka biomarkörer under användarens dagliga aktiviteter. För att åstadkomma detta, de integrerade FESS i en specialutvecklad smartklocka som en modell IOT-enhet som innehåller en analog/digital krets, Bluetooth-sändtagare och en LCD-skärm (Liquid Crystal Display) för funktioner på systemnivå, inklusive signal- och användarkommandobehandling, display och trådlös datakommunikation. Den FESS-baserade smartklockan fungerade på samma sätt som en potentiostat. Forskarna fäste den kompletta smartklockan på huden utan externa omslag eller fixturer för trådlös biomarköravkänning som en fristående enhet. LCD-skärmen visade realtidsavläsningar och tidsprofil för biomarkörmätningarna, medan Bluetooth-mottagaren vidarebefordrade avläsningarna till en specialutvecklad mobilapplikation för att ladda upp data till en molnserver för vidare analys.
Teamet fäste den FESS-baserade smartklockan på en försökspersons underarm för att visa dess funktion som ett bärbart system för att övervaka biomarkörer. Ämnet kunde trådlöst styra enheten för att ta realtid, svettbaserade biomarkörmätningar i förhållande till användarens dagliga rutin. Användaren övervakade sina svettglukosnivåer före eller efter att ha ätit ett blandat utbud av måltider och avläsningen av smartklockan indikerade förhöjda svettglukosnivåer efter matintag, i linje med tidigare trender. Smartklockan gav dessutom användarinformation om svettlaktatavläsningar när du springer på ett fält, resultaten var konsekventa trots inblandning av högfrekventa och högaccelerationsbaserade kroppsrörelser.
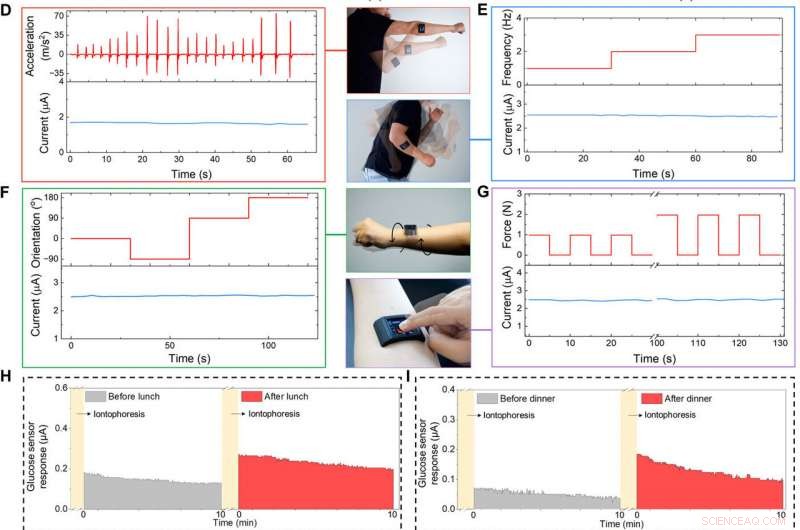
Specialutvecklad FESS-integrerad smartklocka för applicering på kroppen. (A) Illustration av den FESS-aktiverade smartklockan (innehåller FESS, LCD skärm, PCB, och batterienheter inrymda i ett 3D-tryckt fodral). (B och C) Ex situ karakterisering av FESS-PCB glukosavkänningssystemets svar på virvelvibrationer (FESS-elektrod:6 mm2, mikrofluidkanalhöjd:170 μm, och volym:4 μl). Vibrationsaccelerationsprofilerna visas i den övre halvan, och sensorsvaren fångas i den nedre halvan när de testas i PBS (B) och 100 μM glukos i PBS (C). (D till G) Karakterisering av signaltrohet på kroppen av ett FESS-PCB laktatavkännande system med en person som utför skuggboxning (D), armsvängande (E), vridning av handleden (F), och enheten trycker på (G). Accelerationen, frekvens, orientering, och kraftprofiler presenteras i den övre halvan, och sensorsvar fångas i den nedre halvan. (H till J) Övervakning av försökspersonernas metabolitprofiler genom olika dagliga händelser och i olika miljöer. Jontoforetiskt inducerad svettglukos mättes före och efter lunch (H) och middag (I). (J) Mätningar av svettlaktat under träning (en representativ rörelseinducerad accelerationsprofil visas till höger). (Fotokredit:Peterson Nguyen, Kaili Chiu, och Yichao Zhao, University of California, Los Angeles.) Kredit: Vetenskapens framsteg , doi:10.1126/sciadv.aaz0007
På det här sättet, Yichao Zhao och kollegor undersökte vägen för leverans av biomarkörinformation och kände igen nära noll ansträngda regioner inuti en mikrofluidavkännande modul för att konstruera en stamisolerad väg för att bevara biomarkördatans tillförlitlighet. Tunnfilmssystemet som utgjorde den fristående FESS-enheten var bioinspirerad av integrinliknande funktioner för signaltransduktion och signalsammankoppling via dubbelsidig vidhäftning. FESS överbryggade effektivt huden och avläsningselektroniken för att samla biomarkörinformation. Teamet kopplade FESS-systemet sömlöst med en specialutvecklad smartklocka som en bärbar biosensor för att övervaka biomarköravläsningar i realtid genom en användares dagliga rutin. För att kommersialisera prototypen som utvecklats i detta arbete, Zhao et al. föreslå framtida kliniska prövningar för att kartlägga svettbaserade biomarköravläsningar och få information om användarnas fysiologiska status. Fördelarna med detta arbete, inklusive deras enkla integration med bärbar elektronik och högfientlighetsavläsningar kan användas för att utföra storskaliga kliniska undersökningar.
© 2020 Science X Network