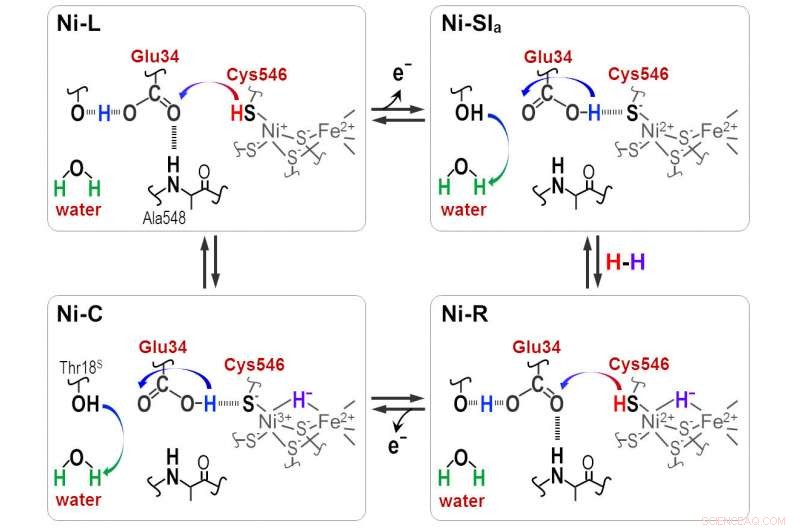
Protoner överförs mellan NiFe -aktiva stället och protein som omger genom Cyt546- och Glu34 -resterna under den katalytiska reaktionen av [NiFe] hydrogenas. Upphovsman:Shun Hirota
För alla de framsteg som tekniken har gjort under våra liv, i många fall står det bakom vad naturen kan göra. Myror kan bära 5000 gånger sin vikt, och spindelnät är fem gånger starkare än stål. Bränsleeffektiviteten är inte annorlunda. I en ny stud i Angewandte Chemie International Edition , forskare från Nara Institute of Science and Technology (NAIST) rapporterar nya detaljer om protonöverföringsvägen för nickel-järn [NiFe] -hydrogenas med hjälp av Fourier transform infraröd spektroskopi (FTIR). Denna överföring är avgörande för väteomsättningen av mikroorganismer, och studien ger forskare en bättre förståelse för hur man efterliknar naturen i konstruktionen av nya biobränsleceller.
Väteomsättningen är en av de äldsta formerna av energiproduktion för livet och en av de mest intensivt studerade på grund av dess betydelse för evolutionen. Det har också väckt uppmärksamhet eftersom det är en ren energikälla. Bland de enzymer som är ansvariga för vätemetabolismen, [NiFe] -hydrogenas är det vanligaste och äldsta.
Mycket är känt om enzymet. Det oxiderar reversibelt väteatomer genom sitt Ni-Fe-aktiva ställe, som omges av specifika aminosyror. Dock, konstaterar NAIST professor Shun Hirota, som skötte studien, vissa grundläggande faktorer i de kemiska reaktionerna måste förstås innan du använder denna nanomaskin för att designa teknik för biobränsle.
"Hydrid och proton koordinerar med Ni-Fe-platsen i protonations-deprotoniseringscykeln, resulterar i fyra hydrogenas -tillstånd. Men protonöverföringsvägen är fortfarande okänd, " han säger.
En orsak till bristen på klarhet har varit en oförmåga att lösa töjningsfrekvenser för olika vätebindningar. I det nya arbetet, Hirotas team, i samarbete med andra forskare i Japan och Kina, löste detta problem genom att observera fotokonversioner av tre hydrogenas -tillstånd med FTIR -spektra.
Hydrogenas katalyserar reversibel oxidation av H2. Upphovsman:Shun Hirota
Tydliga absorbansfrekvenser avslöjade att en av de fyra cysteinerna, cystein 546, tillsammans med en annan aminosyra, glutaminsyra 34, och en ordnad vattenmolekyl är avgörande för överföringen. Forskarna använde den nya informationen för att härleda hur svavelmolekylen i cystein 546 och syragruppen i glutaminsyra 34 bildar vätebindningar för att reglera vätetransporten.
"Våra resultat visar att cystein 546 är en protondonator och acceptor i [Ni-Fe] hydrogenascykeln. De visar också hur en lågbarriär vätebindning för glutaminsyra 34 bildas och klyvs under den katalytiska cykeln, "konstaterar Hirota.
Mikroorganismer har anpassat sig till ett större antal miljöförhållanden än människor. De finns i det bekväma klimatet i våra sovrum mot de mest fientliga miljöerna på jorden. Således, se hur [Ni-Fe] -stället för [Ni-Fe] hydrogenas överför protoner optimalt ger ett paradigm för forskare som vill tillverka högeffektiva energikatalysatorer under en mängd förhållanden.
"Livet har spenderat miljarder år på att anpassa sig till energi. Vi tror att det ger oss den bästa modellen för energieffektivitet i framtiden, säger Hirota.