Upphovsman:McGill University
Forskare vid McGill Universitys medicinska fakultet har gjort viktiga framsteg när det gäller att förstå hur enzymer fungerar som spelar en integrerad roll i produktionen av antibiotika och andra läkemedel. Deras resultat publiceras i Vetenskap .
"Många av de läkemedel som vi förlitar oss på idag är naturprodukter, gjord av jordens flora, "förklarar Dr. Martin Schmeing, Docent vid Institutionen för biokemi vid McGill och studiens seniorförfattare. "Detta inkluderar föreningar gjorda i mikrober av massiva enzymer som kallas nonribosomala peptidsyntetaser, eller NRPS. NRPS syntetiserar alla slags antibiotika, som kan döda farliga svampar och bakterier, samt föreningar som hjälper oss att bekämpa virusinfektioner och cancer. Till exempel, dessa föreningar inkluderar viomycin, ett antibiotikum som används för behandling av multiresistent tuberkulos; cyklosporin, som har använts i stor utsträckning som immunsuppressivt medel vid organtransplantationer; och det välkända antibiotikumet penicillin. "
För att syntetisera dessa läkemedel, NRPS fungerar på samma sätt som en fabriksmonteringslinje, som består av en serie arbetsstationer. Varje station, kallas en "modul, "har flerstegs arbetsflöden och rörliga delar som gör det möjligt att lägga till en byggstenskomponent till det växande läkemedlet.
Förstå löpande bandets inre funktioner
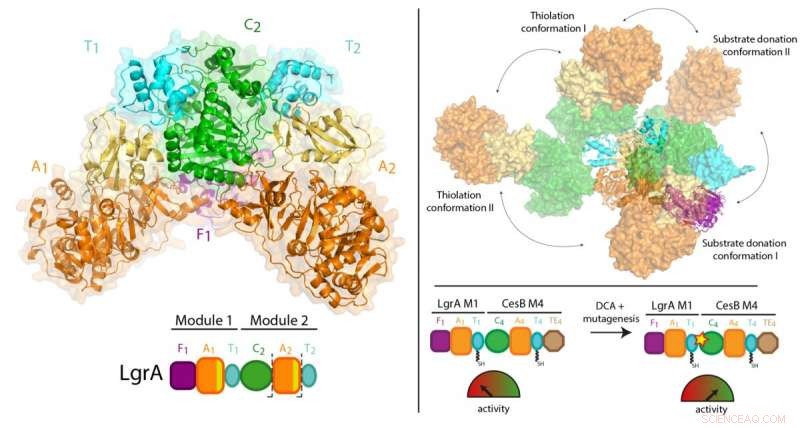
Tidigare arbete av Dr Schmeing och andra har lett till en gedigen förståelse för hur en modul fungerar. Nu, med hjälp av en teknik som kallas röntgenkristallografi vid den kanadensiska ljuskällan i Saskatchewan, och den avancerade fotonkällan i Illinois, laget kunde ta 3D-bilder med ultrahög upplösning av NRPS.
För första gången, de kunde göra högkvalitativa observationer om hur en enskild modul förhåller sig till det större löpande bandet, genom att visualisera en tvåmodulerad del av NRPS som gör antibiotikumet linjärt gramicidin (finns i Polysporin-behandlingar). Studien fann en överraskande brist på synkronisering mellan moduler på alla andra punkter än när de måste samordna för att överföra mellanprodukten från en arbetsstation till nästa. Dessutom, de fann att modulerna inte står i linje med en rak linje eller på annat organiserat sätt, men kan istället ställa upp i många olika relativa positioner. "Denna nivå av massiv flexibilitet förväntades inte, "konstaterar Dr Schmeing, som också är chef för McGills Center for Strukturell biologi. "Enzymerna utför gymnastik."
Eftersom proteinerna är fångade i en kristall, omsorg togs för att bekräfta att resultaten var representativa för vad som händer i verkliga livet. Dr Schmeing arbetade med sin kollega, Dr Alba Guarné, Professor vid Institutionen för biokemi vid McGill, att använda kompletterande lösningsdata, samlas in vid Advanced Light Source i Berkeley för att validera observationerna. "Det strukturella biologiska samhället är mycket starkt på McGill. Vi arbetar tillsammans för att hjälpa varandra i samarbeten, att få den biofysiska utrustning som krävs för banbrytande experiment, och att utbilda våra studenter ", säger Dr Schmeing, noterar att experimenterna på pappret, Janice Reimer, Max Eivaskhani och Ingrid Harb, är alla begåvade McGill -doktorander. "Miljön och kollegor vid McGill Center for Strukturell biologi är viktiga för våra laboratoriers fortsatta framgång."
Framtida konsekvenser för terapeutisk design
Resultaten kan få konsekvenser för produktionen av nya antibiotika och läkemedel på lång sikt. Sedan de först upptäcktes, forskare har varit glada över möjligheten att bioingenjör NRPS genom att blanda och matcha arbetsstationer för att producera designerföreningar. "Vår studie visar att det borde vara möjligt att blanda och matcha dessa moduler, men att de bioingenjörs NRPS måste modifieras vid de punkter som är involverade i att föra föreningen från en modul till nästa för att få dem att fungera bra, "förklarar Dr Schmeing." Detta är något vi samarbetade med Martin Weigt från Sorbonne för att göra som ett principbevis i tidningen, men som kommer att behöva optimeras för produktion av designerterapier. "
"Strukturer av ett dimodulärt nonribosomalt peptidsyntetas avslöjar konformationsflexibilitet, "av Reimer, J. M., Eivaskhani, M, Harb, I., Guarne, A, Weigt, M., Schmeing, T. M. publicerades i tidskriften Vetenskap .