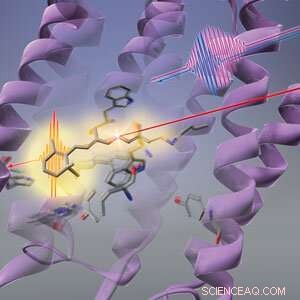
Figur 1:RIKEN-forskare har funnit att ljus (lång röd linje) först gör att formen på proteinet (lila virvlar) ändras innan den retinala kromoforen (stickliknande struktur) i bakteriohodopsin genomgår fotoisomerisering. © 2019 RIKEN Center for Advanced Photonics
Sekvensen av förändringar som ljus utlöser i en bakteriell fotoreceptor börjar med dess proteinställning snarare än den ljusabsorberande kromoforen, ett all-RIKEN-lag har visat. Detta fynd går emot konventionell visdom och kastar nytt ljus över hur fotoreceptorer så effektivt kan omvandla ljus till kemisk energi.
Många bakterier använder speciella ljuskänsliga molekyler som kallas fotoreceptorproteiner för att omvandla ljus till kemisk energi, som de använder för att initiera olika biologiska funktioner.
Forskare har länge velat veta hur bakteriella fotoreceptorer är så effektiva när det gäller att omvandla ljus. "En av de grundläggande frågorna är hur dessa biomolekyler uppnår så hög effektivitet, lågenergi fotoreaktioner, " säger Tahei Tahara. "Detta har varit en långvarig fråga." En motivation för att avslöja mekanismen för dessa fotoreceptorer är att det skulle kunna informera ansträngningar att utveckla artificiella versioner av dessa molekyler.
Den mest väl studerade bakteriella fotoreceptorn, bakteriodopsin, innehåller en retinal kromofor, som ändrar form när den absorberar en foton av gult ljus. Denna konfigurationsändring sätter igång en serie strukturella förändringar i bakteriohodopsin som gör det möjligt för det att pumpa protoner.
Intressant, när den retinala kromoforen av bakteriorhodopsin placeras i lösning, dess ljusomvandlingseffektivitet är tre gånger lägre än när den är inbäddad i proteinstrukturen hos bakteriorodopsin. Detta indikerar tydligt att proteinet spelar en viktig roll för att hjälpa omvandlingen av ljus till kemisk energi.
Konformationsförändringen av den retinala kromoforen antogs vara det första svaret av bakteriohodopsin på ljus. Men Tahara och hans medarbetare vid RIKEN Molecular Spectroscopy Laboratory och RIKEN Center for Advanced Photonics har nu upptäckt att det finns ett steg som föregår det - proteinet som vaggar näthinnekromoforen ändrar först sin form som svar på ljus. Denna förändring i proteinet kan hjälpa den retinala kromoforen att använda ljus effektivt.
Teamet tog en spektroskopisk teknik som kallas femtosekundstimulerad Raman-spektroskopi, som kan observera processer som sker snabbare än en pikosekund (1 pikosekund =10−12 sekunder), och utökade den till den djupa ultravioletta regionen. Detta gjorde det möjligt för dem att titta på proteindelen av bakteriorodopsin.
Denna upptäckt kom som en överraskning för Tahara. "Jag förväntade mig inte att proteinet skulle ändra form före kromoforisomerisering, men när jag såg de experimentella resultaten tänkte jag "Wow, det är faktiskt så, '" säger han. "Det var högst överraskande, och vi var väldigt exalterade."
Medan teamet tittade på bakteriohodopsin i denna studie, de räknar med att samma effekt mycket väl skulle kunna uppstå i andra rhodopsiner.