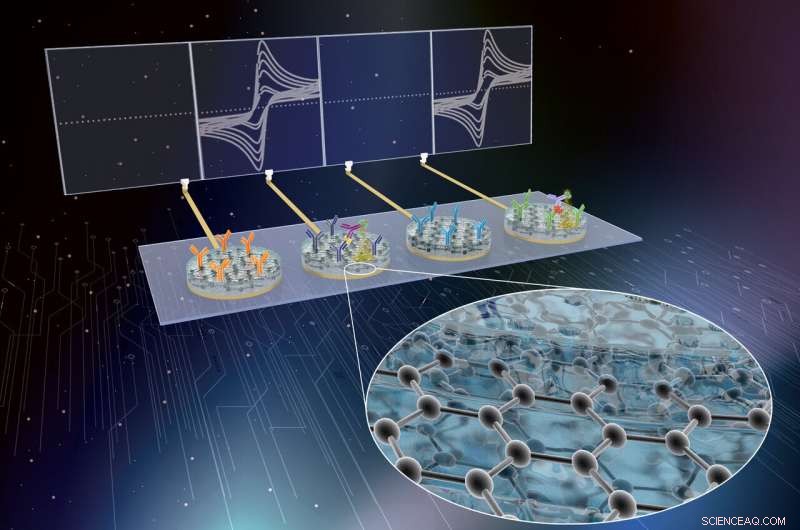
Forskare från Wyss Institute har utvecklat eRapid-teknologi som en affinitetsbaserad, låg kostnad elektrokemisk diagnostisk sensorplattform för multiplexerad detektering av kliniskt relevanta sepsisbiomarkörer i helblod. Kredit:Wyss Institute vid Harvard University
Många livshotande medicinska tillstånd, som sepsis, som utlöses av blodburna patogener, kan inte upptäckas tillräckligt exakt och snabbt för att inleda rätt behandlingsförlopp. Hos patienter som har infekterats av en okänd patogen och utvecklats till tydlig sepsis, varje ytterligare timme som ett effektivt antibiotikum inte kan administreras ökar dödligheten avsevärt, så tiden är av yttersta vikt.
Utmaningen med att snabbt diagnostisera sepsis beror på att mätning av endast en biomarkör ofta inte tillåter en entydig diagnos. Ingenjörer har kämpat i årtionden för att samtidigt kvantifiera flera biomarkörer i helblod med hög specificitet och känslighet för point-of-care (POC) diagnostiska tillämpningar eftersom detta skulle undvika tidskrävande och kostsamma blodbearbetningssteg där informativa biomarkörmolekyler potentiellt skulle kunna gå förlorade .
Nu, ett tvärvetenskapligt team vid Harvards Wyss Institute for Biologically Inspired Engineering och University of Bath, STORBRITANNIEN, ledd av Wyss grundare Donald Ingber, M.D., Ph.D., och Wyss seniorforskare Pawan Jolly, Ph.D., har vidareutvecklat institutets eRapid-teknologi som en affinitetsbaserad, låg kostnad elektrokemisk diagnostisk sensorplattform för multiplexerad detektering av kliniskt relevanta biomarkörer i helblod. Enheten använder en ny grafen-nanokompositbaserad ytbeläggning och visade sig exakt detektera tre olika sepsisbiomarkörer samtidigt. Fynden redovisas i Avancerade funktionella material .
"I den här studien, vi har tagit ett viktigt steg mot att distribuera vår elektrokemiska sensorplattform i kliniska miljöer för snabb och känslig detektering av flera analyter i mänskligt helblod. Eftersom nanokompositbeläggningen vi utvecklade här är billig, den har potentialen att revolutionera diagnostik på vårdställen, inte bara för att testa för sepsisbiomarkörer, men ett mycket bredare utbud av biomarkörer som kan multiplexeras i uppsättningar för att rapportera om tillstånden för många sjukdomar och tillstånd, sa Ingber, som också är ledare för Wyss Institutes Bioinspired Therapeutics and Diagnostics-plattform, och Judah Folkman professor i vaskulär biologi vid Harvard Medical School och Boston Children's Hospital, och professor i bioteknik vid SEAS.
Ingber, Jolly och deras Wyss-team utvecklar för närvarande också eRapid elektrokemiska sensorer med den nykonstruerade grafenbaserade nanokompositbeläggningen som en kritisk komponent i en punkt-of-care diagnostik för COVID, traumatisk hjärnskada, hjärtinfarkt, och många andra störningar.
Genom att utveckla sin elektrokemiska sepsis-avkänningsteknik, Ingbers team byggde på tidigare arbete publicerat i Naturens nanoteknik , där de hade löst problemet med "biofouling" med elektrokemiska avkänningselement med sin eRapid-teknik. I teorin, elektrokemiska biosensorer skulle föredras för många kliniska tillämpningar på grund av deras förmåga att kvantifiera innehållet i biologiska prover genom att direkt omvandla bindningshändelsen för en biomarkör till en elektronisk signal, deras låga energiförbrukning och kostnad, och enkel integration med diagnostiska läsare. Dock, speciellt när man använder helblod, många blodkomponenter binder ospecifikt till ytbeläggningarna på sensorernas elektroder och leder till deras nedbrytning, samt elektriskt brus i form av falska signaler.
Teamets eRapid-teknologi använder en ny antifouling nanokompositbeläggning för elektroder till vilka bindningsreagenser är fästa som fångar upp biomarkörmolekyler från små mängder blod och andra komplexa biologiska vätskor. Vid kemisk detektering av någon av dessa biomarkörmolekyler med hög känslighet och selektivitet, eRapid-plattformen genererar en elektrisk signal vid elektroderna som korrelerar i styrka med nivåerna av målmolekyler som detekteras. Den initiala nanokompositbeläggningen möjliggjorde utmärkt omvandling av kemiska till elektriska signaler, och förlitade sig på små elektriskt ledande guld nanotrådar som var inbäddade i en matris av ett tvärbundet protein känt som bovint serumalbumin. Dock, de höga kostnaderna för guldmaterialen hade varit det största hindret för att kommersialisera eRapid för kliniska tillämpningar.
"I vår avancerade eRapid-version, vi ersatte beläggningens guldnanotrådar med grafenoxid-nanoflingor som också har antifouling och elektrokemiska egenskaper, men de är mycket billigare och tillåter ännu känsligare mätningar. Faktiskt, kostnaderna för att tillverka nanokompositen reducerades till en bråkdel av dess ursprungliga kostnad, vilket tillsammans med avkänningsteknikens hastighet, effektivitet, och mångsidighet bör göra det möjligt för eRapid-plattformen att få omedelbar kommersiell effekt, sa Jolly.
Efter att ha optimerat och karakteriserat deras nanokompositbeläggning i bindningsanalyser för det inflammatoriska cytokinet interleukin 6, teamet tillämpade det på diagnosen sepsis. Väsentligen, genom att fästa en antikroppsmolekyl till beläggningen som binder prokalcitonin (PCT), och lägga till en andra PCT-specifik antikropp till komplexet som är kopplat till ett enzym, en fällning bildas från ett kemiskt substrat och avsätts på beläggningen. Detta ändrar strömmen av elektroner som når elektroden, och hjälper till att registrera PCT-bindningshändelsen som en elektronisk signal.
"Vi visade att detta elektrokemiska sensorelement kan detektera PCT med hög noggrannhet i helblod, och validerade det genom att kvantifiera PCT-nivåer i 21 kliniska prover, direkt jämföra den med en konventionell ELISA-analys - med utmärkt korrelation, " sa förstaförfattaren Uroš Zupančič, som var gästforskare i Ingbers grupp från University of Bath. Zupančič är en Ph.D. kandidat mentorerad av studiens medförfattare Despina Moschou, Ph.D., en lektor vid University of Bath, och Pedro Estrela, Ph.D., Docent och chef för Centrum för biosensorer, Bioelektronik och bioutrustning vid universitetet.
Teamet utökade sedan sitt tillvägagångssätt för att samtidigt upptäcka flera biomarkörer för sepsis genom att också designa sensorelement för C-reaktivt protein, en annan sepsis biomarkör, och patogenassocierade molekylära mönster (PAMP). PAMP-sensorelementet utnyttjar i synnerhet Wyss Institutes bredspektrumpatogenfångstteknologi som använder ett genetiskt modifierat protein som heter FcMBL, som binder mer än 100 olika patogener av alla klasser, samt molekyler på deras ytor som släpps ut i blodet när patogener dödas (PAMPs) och verkar för att utlösa sepsiskaskaden.
"Att montera tre dedikerade elektrokemiska sensorelement för biomarkörer som kan finnas i blodet i mycket olika koncentrationer på ett enda chip utgjorde en betydande utmaning. de tre elementen i den slutliga sensorn uppvisade specifika svar inom det kliniskt signifikanta intervallet utan att störa varandra, och de gjorde det med en handläggningstid på 51 minuter, som tillgodoser det kliniska behovet av sepsisdiagnos inom den första timmen, " sa Zumpančič.
För att göra den nuvarande eRapid-teknologin ännu mer effektiv och användbar för klinisk provanalys, teamet integrerade det med ett mikrofluidsystem som tar ut det mänskliga elementet som är involverat i hanteringen av sensorn i laboratoriet, och ökar antalet biomarkörbindningshändelser på dess yta. Detta gör att biomarkörsanalys med systemet kan automatiseras, och gjorde det möjligt för forskarna att minska omloppstiden för att mäta PCT till 7 minuter.