Nya strategier för småmolekylära lim. Kredit:Eindhovens tekniska universitet
Många av de för närvarande tillgängliga läkemedlen är inte tillräckligt specifika för att effektivt bota komplexa sjukdomar som cancer, neurodegenerativa sjukdomar och diabetes. Dessutom, läkemedelsresistens minskar effektiviteten av befintliga terapier. För att lösa dessa problem, biomedicinsk ingenjör Eline Sijbesma designade små molekyler som avväpnar specifika sjukdomsproteiner genom att limma dem till andra proteiner. Dessa kan leda till mer stabila och effektiva läkemedel och, bland annat, kan bidra till en ny behandling för resistent bröstcancer, som för närvarande inte finns någon behandling för. Sijbesma försvarar sin doktorsexamen. avhandling den 2 december vid TU/e.
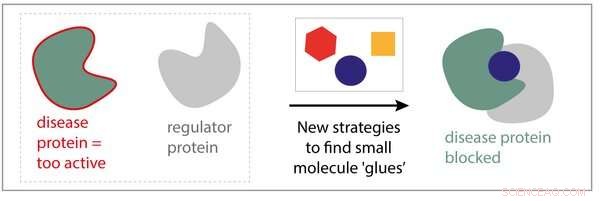
Om du föreställer dig cellen som livets minsta fabrik, tänk sedan på proteiner som maskinerna i dessa fabriker, gör allt arbete. I likhet med maskiner i en produktionslinje, proteiner fungerar inte isolerat; de behöver varandra för att fungera. Fysiska interaktioner mellan proteiner skapar viktiga signalnätverk, gör det möjligt för celler att snabbt och adekvat reagera på externa signaler. Vid sjukdom, ofta fungerar ett enda protein inte bra, eller är för aktiv. Aktiviteten hos dessa sjukdomsrelaterade proteiner kan korrigeras genom att tätt binda dem till läkemedel med små molekyler som kan återställa deras normala funktion. Dock, detta tillvägagångssätt är inte alltid framgångsrikt och även om det är, sjuka celler hittar ofta vägar runt behandlingen.
Två är bättre än en
Eline Sijbesma, Ph.D. student i forskargruppen för kemisk biologi ledd av professor Luc Brunsveld:"Istället för att fokusera på ett enda protein och försöka hitta ett specifikt läkemedel för det, varför siktar vi inte på att göra läkemedel som binder till ett komplex som bildas av två proteiner?" Sijbesmas hypotes är att om vi kan utveckla molekyler som stabiliserar interaktionen mellan ett protein och ett annat, vi kanske kan "limma" ett sjukdomsprotein till ett "regulatorprotein" som förhindrar dess dåliga aktiviteter. Dessutom, dessa molekyler är mycket mer selektiva, eftersom de bara binder proteinkomplexet, inte de två enskilda proteinerna, vilket resulterar i färre biverkningar.
Tät och stark
Tillsammans med University of California San Francisco (UCSF) och Novartis Institutes for Biomedical Research (NIBR), Sijbesma var pionjär med flera läkemedelsupptäcktsstrategier med användning av mycket små molekyler (fragment) som utgångspunkter. Sijbesma:"Vi identifierade flera fragment med önskade egenskaper och kombinerade dem på ett smart sätt, att bilda en ny molekyl med ännu bättre egenskaper. Vi visade att den nya molekylen verkligen kan binda till två proteinpartners samtidigt, vilket gör proteinkomplexet upp till 40 gånger starkare."
Bröstcancer
Utvecklingen av dessa "molekylära lim" har en stor potential för vissa typer av resistent bröstcancer. De senare uppvisar ofta en överaktiv receptor (östrogenreceptor α), som för närvarande är ineffektivt inriktat via droger som försöker blockera dess aktivitet direkt. I en nyligen publicerad publikation, Sijbesma visade att stabilisering av interaktionen mellan denna receptor och ett regulatorprotein kan vara rätt väg att gå. Sijbesma:"Denna receptor är känd för att vara nedreglerad av ett specifikt protein, navproteinet 14-3-3σ. Således, vi designade molekylära lim som tätt kan fånga receptorn med detta specifika protein och inaktivera det.
Bortom cancer
För Sijbesma, den centrala innovationen i hennes forskning är etableringen av det underliggande biologiska konceptet med ett molekylärt lim för två proteiner. Detta kan leda till nya vägar inom läkemedelsutveckling och behandling av flera sjukdomar. Sijbesma:"Detta tillvägagångssätt är inte begränsat till tillämpningar inom bröstcancer, men det kan vara användbart i framtiden för utvecklingen av nya terapier för sjukdomar som neurodegeneration, inflammation, cystisk fibros och diabetes."