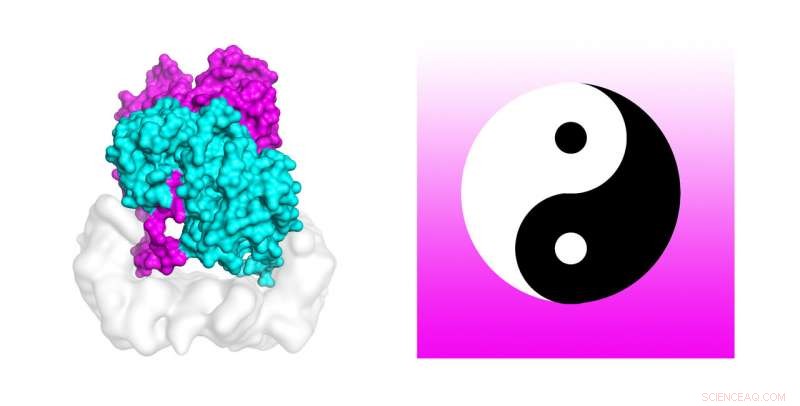
Forskare använder kraftfulla superdatorer för att avslöja mekanismen som aktiverar cellmutationer som finns i cirka 50 procent av melanom. Molekylär dynamiksimuleringar på TACC:s Stampede2 superdator testade stabiliteten hos strukturen av B-Raf:14-3-3 komplex, som när den är muterad är kopplad till hudcancer. Studieförfattarna jämför B-Raf-dimeren med den kinesiska yin-yang cirkulära symbolen för sammankopplade motsatser förenade vid svansen. Kredit:Karandur et al., TACC
Det börjar smått, bara en hudfläck. De vanligaste mullvadarna förblir precis så – ofarliga kluster av hudceller som kallas melanocyter, som ger oss pigment. I sällsynta fall, det som börjar som en mullvad kan förvandlas till melanom, den allvarligaste typen av mänsklig hudcancer eftersom den kan spridas i hela kroppen.
Forskare använder kraftfulla superdatorer för att avslöja mekanismen som aktiverar cellmutationer som finns i cirka 50 procent av melanom. Forskarna säger att de är hoppfulla att deras studie kan hjälpa till att leda till en bättre förståelse av hudcancer och till utformningen av bättre läkemedel.
År 2002, forskare fann ett samband mellan hudcancer och mutationer av B-Raf (snabbt accelererat fibrosarkom) kinas, ett protein som är en del av signalkedjan som börjar utanför cellen och går in för att styra celltillväxt. Denna signalväg, kallas Ras/Raf/Mek/Erk kinasvägen, är viktigt för cancerforskningen, som försöker förstå okontrollerad celltillväxt. Enligt studien, cirka 50 procent av melanom har en specifik mutation på B-Raf, känd som valin 600-resten till glutamat (V600E).
B-Raf V600E blev därmed ett viktigt läkemedelsmål, och specifika inhibitorer av mutanten utvecklades under de följande åren. Läkemedlen hämmade mutanten, men något konstigt hände. Paradoxalt, tysta mutanten hade en baksida. Den aktiverade den omuterade, vildtyp B-Raf proteinkinaser, vilket återigen utlöste melanom.
"Med denna bakgrund, vi arbetade med att studera strukturen av detta viktiga protein, B-Raf, " sa Yasushi Kondo, en postdoktor vid John Kuriyan Lab vid UC Berkeley. Kondo är medförfattare till en studie från oktober 2019 i tidskriften Vetenskap som bestämde strukturen av komplexet av proteiner som utgör B-Raf och fann också hur den paradoxala B-Raf-aktiveringen sker.
"Vi syftade till att studera proteinets mer inhemska tillstånd för att förstå hur det regleras i cellerna, eftersom de flesta av studierna har fokuserats på den isolerade kinasdomänen och hur läkemedlen binder till kinasdomänen." sa Kondo.
B-Raf-proteinet i full längd är tillverkat av flera domäner länkade av oordnade regioner, något för ohanterligt för forskare att ännu föreställa sig. Kondos teknik var att använda inteinkemi för att göra mindre fragment, sy sedan ihop dem för att få hela strukturen.
"Som ett resultat, vi erhöll en aktiv form av fullängds B-Raf dimer som kallas B-Raf samrenad med 14-3-3 dimer, ett ställningsprotein bundet till den fosforylerade B-Raf C-terminala svansen, " sa Kondo.
Kondos grupp använde kryo-elektronmikroskopi (cryo-EM) för att bestämma strukturen av B-Raf 14-3-3 komplex, i princip kryogen frysning av proteinkomplexet, som höll det i en kemiskt aktiv, nästan naturlig miljö. Därefter flashade de det med elektronstrålar för att få tusentals "frysramar". De sållade bort bakgrundsljud och rekonstruerade tredimensionella densitetskartor som visade tidigare okända detaljer i formen av molekylen. Och för proteiner, form följer funktion.
Kondo förklarade att strukturen avslöjade en asymmetrisk organisation av komplexet, bildad av två uppsättningar internt symmetriska dimerer, eller par av bundna molekyler. "Vi föreslår att detta oväntade arrangemang möjliggör asymmetrisk aktivering av B-Raf-dimeren, vilket är en mekanism som ger en förklaring av ursprunget till den paradoxala aktiveringen av B-Raf av små molekylhämmare, " sa Kondo.

Superdatorn Stampede2 vid Texas Advanced Computing Center är en tilldelad resurs från Extreme Science and Engineering Discovery Environment (XSEDE) finansierad av National Science Foundation (NSF). Kredit:TACC
Detaljerad analys av den asymmetriska B-Raf 14-3-3 komplexa strukturen visade en annan oväntad strukturell egenskap, beskrivs som det distala svanssegmentet, DTS för kort, av en B-Raf-molekyl. Kondo sa att svansen på den ena är bunden till den andras aktiva plats, blockerar dess aktivitet genom att konkurrera med ATP-bindning. Den blockerade B-Raf-molekylen stabiliseras i den aktiva konformationen. "Vi tolkade denna struktur att denna blockerade B-Raf-molekyl fungerar som en aktivator och stabiliserar den andra B-Raf-mottagaren genom dimergränssnittet, " sa Kondo.
Märkligt nog, författarna jämför B-Raf-dimeren med den kinesiska yin-yang cirkulära symbolen för sammankopplade motsatser förenade vid svansen. "Från att titta på ämnet, det är väldigt tydligt att man inte är kapabel att fosforylera nedströmsmolekylen, som är nödvändigt för celltillväxt. Den andra molekylen är helt klart den som gör jobbet. I denna uppsättning av två molekyler, vi ser tydligt att en gör det stödjande jobbet, och den andra gör själva jobbet. Det ser verkligen ut som Yin och Yang i detta B-Raf 14-3-3-komplex som vi löste, " sa Kondo.
Utseende, fastän, kan lura. Forskare använde datorsimuleringar för att verifiera att de verkligen var inne på något. "Vi körde molekylära dynamiksimuleringar av detta komplex av B-Raf-dimeren bunden till en 14-3-3 dimer för att testa stabiliteten hos den asymmetriska konformationen, " sa studiens medförfattare Deepti Karandur, också en postdoktor vid John Kuriyan Lab vid UC Berkeley; hon är också postdoktor vid Howard Hughes Medical Institute. "Vi visste inte varför konformationen var asymmetrisk, eller vilken roll det spelade för att upprätthålla enzymets aktiva tillstånd, sa Karandur.
De startade simuleringarna med hjälp av strukturen som Kondo hade löst av cryo-EM, med DTS-segmentet som löper från ett kinas till det aktiva stället för det andra. Sedan körde de en andra uppsättning simuleringar med DTS-segmentet borttaget.
"Vad vi fann var att i systemet utan det distala svanssegmentet, hela komplexet är inte stabilt, " Karandur förklarade. "Kinasdomänerna rör sig i förhållande till byggnadsställningarna, 14-3-3 dimeren. I en av våra simuleringar, det dimera tillståndet för B-Raf själv, vilka experiment har visat är nödvändiga för att upprätthålla det aktiva tillståndet för detta kinas, den föll isär, vilket indikerar att detta distala svanssegment, DTS, är nödvändigt för att faktiskt upprätthålla detta komplex i denna asymmetriska konformation, vilket i sin tur är nödvändigt för att bibehålla kinasdimeren i det stabila asymmetriska dimeraktiva tillståndet."
Ett av studiens huvudresultat var att hitta verkningsmekanismen som kopplar på B-Raf-kinaskomplexet av två B-Raf-kinaser och två 14-3-3 ställningsproteiner, där på B-Raf kinas är aktivatorn, och den andra är mottagaren.
"Svansen på mottagarmolekylen är inuti aktivatorns aktiva plats, så aktivatorn kan inte fungera som ett enzym, " sa Kondo. "Istället, aktivatormolekylen stabiliserar mottagarmolekylens aktiva konformation. 14-3-3 ställningsproteinet underlättar detta arrangemang, så att svansinsättningen bara sker med en kinasmolekyl. Vi antar att när det inte finns någon 14-3-3-bindning, båda kinaserna kan blockeras genom införandet av DTS, men det här måste testas."
Studiens beräkningsmässiga utmaningar involverade simuleringar av molekylär dynamik som modellerade proteinet på atomnivå, bestämma krafterna för varje atom på varannan atom för ett system på cirka 200, 000 atomer i tidssteg på två femtosekunder.
"För små system, vi kan se vad som händer relativt snabbt, men för stora system som dessa, speciellt stora biomolekylära system, dessa förändringar sker på liknande nanosekunders tidsskalor, mikrosekunders tidsskalor, eller till och med millisekunders tidsskalor, sa Karandur.
Karandur och kollegor vände sig till XSEDE, den NSF-finansierade Extreme Science and Engineering Discovery Environment, för tilldelningstid på superdatorn Stampede2 vid Texas Advanced Computing Center (TACC) för att göra simuleringarna, samt Bridges-systemet vid Pittsburgh Supercomputer Center för att undersöka andra proteiner i vägen. Stampede2s Skylake-processornoder, nätverk med Intel Omnipath, gjorde snabbt arbete med de optimerade för superdatorer NAMD molekylära dynamiksimuleringar.
"Stampede2 går väldigt, väldigt snabbt, och det är väldigt effektivt. Vi genererade totalt cirka 1,5 mikrosekunders banor för våra system på cirka fyra till sex veckor. Medan om vi körde det på vårt eget interna kluster skulle det ha tagit oss månader eller längre, sa Karandur.
Om XSEDE, Karandur kommenterade:"Jag tycker att det är en fantastisk resurs. Jag har kört simuleringar från när jag var doktorand. XSEDE gjorde det möjligt för oss att få tillgång till tidsskalor som är biologiskt relevanta. Allt som händer i en cell, händer på mikrosekunders tidsskalor, till millisekunders tidsskalor, till längre. När jag började, vi kunde inte köra den här simuleringen på något system någonstans. Jag menar, det skulle ha tagit fem år, eller mer. Att kunna göra det på veckor och säga, Okej, vi vet att förstå varför detta är viktigt så att vi nu kan börja få verklig förståelse för hur biologin händer, är bara fantastiskt, sa Karandur.
Och det återstår mycket att upptäcka om B-Raf. Det är bara en länk i signalkedjan som styr celltillväxt och cancer.
"Strukturen som löstes i detta dokument är en del av ett stort, multidomänsystem, " Karandur förklarade. "Vi vet inte hur detta kompletta protein ser ut. Vi ser det inte i strukturen. Vi vet inte hur dess dynamik ser ut, och hur alla dessa andra delar av proteinet spelar en roll för att upprätthålla det aktiva tillståndet, eller konvertera det från det inaktiva tillståndet till det aktiva tillståndet."
Hon sa vidare att när systemet blir större, de relevanta strukturella förändringarna sker över längre tidsskalor, och större superdatorer behövs för att hantera komplexiteten, som den NSF-finansierade superdatorn Frontera, även på TACC.
"Frontera är på väg dit. Vi är väldigt glada över detta. Vi håller på att få en tilldelning på Frontera, sa Karandur.
För icke-vetenskapsmän, denna grundläggande forskning skulle kunna ge insikter som leder till bättre läkemedel mot hudcancer.
"Den paradoxala aktiveringen av Raf-kinas av dessa B-Raf-specifika hämmare förvandlar normala celler till tumörer under hudcancerbehandling, ", sa Kondo. Genom att förstå mekanismen för detta fenomen kommer vi att kunna designa bättre läkemedel. Förhoppningsvis, vår studie kan bidra till förståelsen av detta steg. Dessutom, vi hittade mutationer i denna länk mellan Kinas-domänen och det 14-3-3-bindande elementet i B-Raf-molekylen, som aldrig visats tidigare. Denna mutation minskar aktiviteten av B-Raf i cellerna. Det indikerar också att denna del av kinasdomänen kan vara en målpunkt för att utveckla nya typer av B-Raf-hämmare."
Sa Karandur:"Det händer mycket dynamik i cellen. Vi är, till stor del på grund av XSEDE, börjar bara kunna titta på sånt. Går framåt, det enda sättet vi kan fortsätta att se på saker och ting är genom att använda mycket, mycket stora superdatorer, eftersom beräkningarna kräver mycket beräkningskraft. Det är verkligen spännande att faktiskt kunna se dessa saker hända och säga, här är hur saker och ting förändras på atomnivå; här är dessa interaktioner mellan dessa två atomer bildas eller bryts, och det leder till denna enorma förändring på global nivå i proteinets övergripande struktur, och hur det interagerar med andra proteiner, eller andra molekyler i cellen. Vi är väldigt spända på vart det kommer att ta vägen i framtiden."
Studien, "Cryo-EM-struktur av ett dimert B-Raf:14-3-3-komplex avslöjar asymmetri i de aktiva platserna för B-Raf-kinaser, " publicerades 4 oktober, 2019 i tidningen Vetenskap .