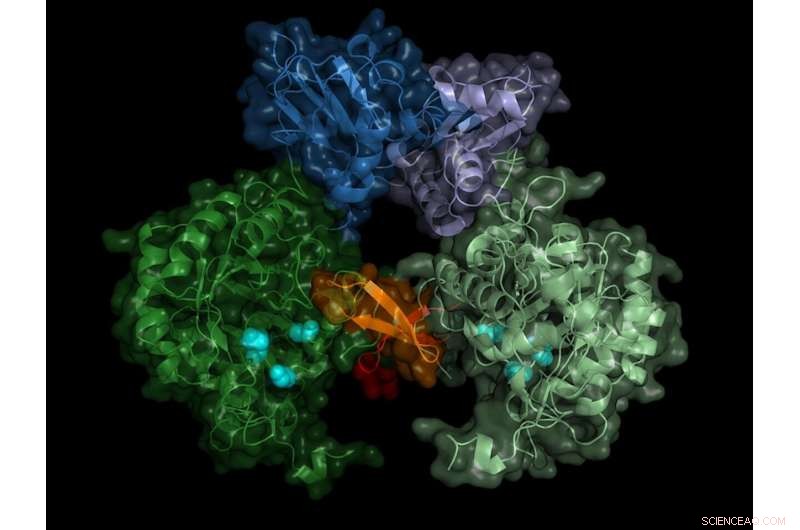
Struktur av parasitens IMP -dehydrogenas. Det aktiva enzymet bildar par (dimerer), "switch" -regionen (Bateman -regionen) visas i blå nyanser. Kredit:University of Lübeck/DESY, Lars Redecke
Med ultra-ljusa röntgenblixtar, ett team av forskare har spårat upp ett potentiellt mål för nya läkemedel mot sömnsjuka:Forskarna har avkodat den detaljerade rumsliga strukturen för ett viktigt enzym av patogenen, parasiten Trypanosoma brucei. Resultatet ger en möjlig plan för ett läkemedel som specifikt blockerar detta enzym och därmed dödar parasiten, som laget under ledning av Christian Betzel från universitetet i Hamburg, Lars Redecke från universitetet i Lübeck och DESY, och Henry Chapman från DESY rapporterar i tidningen Naturkommunikation .
Sovsjuka (afrikansk trypanosomiasis) är en tropisk sjukdom som orsakas av parasiten Trypanosoma brucei, som överförs av tsetseflugor, som bor i stora delar av det tropiska Afrika. I kroppen, parasiten förökar sig först under huden, i blodet och i lymfsystemet och migrerar sedan till centrala nervsystemet. Om den lämnas obehandlad, sjukdomen är nästan alltid dödlig. Tack vare intensiva kontrollåtgärder, antalet registrerade fall har minskat dramatiskt de senaste åren. Ändå, sömnsjuka anses fortfarande vara en av de mest betydande tropiska sjukdomarna. Enligt Världshälsoorganisationen, mer än 60 miljoner människor på landsbygden i Afrika söder om Sahara är i fara. Krig, förskjutning och migration kan få sjukdomen att blossa upp.
I sökandet efter en möjlig utgångspunkt för läkemedel mot patogenen, forskarna hade riktat in sig på ett centralt enzym i den encelliga organismen, inosin-5'-monofosfatdehydrogenas (IMPDH). "Detta enzym tillhör den centrala inventeringen av varje organism och är ett intressant mål för läkemedel eftersom det reglerar koncentrationen av två vitala nukleotider i cellen:guanosindifosfat och guanosintrifosfat, "säger Redecke." Cellen behöver dessa nukleotider för att leverera energi och för att bygga större strukturer som genomet. Om du avbryter denna cykel, cellen dör. "
Enzymet har en slags på/av -omkopplare som aktiveras genom dockning av cellens egna molekyler. Ett lovande tillvägagångssätt är att blockera denna switch med en exakt skräddarsydd molekyl. För att konstruera en sådan hämmare, switchens exakta rumsliga struktur måste vara känd. Strukturbiologer kan bestämma strukturen för biomolekyler med hjälp av röntgenstrålar. Att göra detta, de odlar först små kristaller från biomolekylerna, som sedan genererar karakteristiska diffraktionsmönster när de belyses med röntgenstrålar. Från dessa mönster har kristallens atomstruktur och dess byggstenar, biomolekylerna, kan beräknas.
Detta tillvägagångssätt kompliceras ofta av de flesta biomolekylers svårighet att bilda kristaller. Och om sådana kristaller kan odlas, de är vanligtvis extremt känsliga för högenergiröntgenstrålarna och förstörs snabbt. "Även om strukturerna för många IMP -dehydrogenaser redan är kända, det hade inte lyckats växa kristaller av Trypanosoma brucei -versionen av enzymet, "rapporterar Betzel, som också är forskare i Cluster of Excellence CUI:Advanced Imaging of Matter vid University of Hamburg och DESY.

Sjukdomen överförs av tsetseflugan. Upphovsman:CDC, Kay DeWitt (public domain)
Teamet valde därför en alternativ väg:gruppen medförfattare Michael Duszenko vid universitetet i Tübingen fick vissa insektsceller att kristallisera biomolekyler inom dem. Med denna så kallade cellulokristallisation, samma team hade redan dechiffrerat ett annat nyckelenzym av sömnsjukdomspatogenen, katepsin B, vilket också är ett potentiellt läkemedelsmål. Det visade sig att de förändrade insektscellerna också producerar kristaller av dehydrogenas som nu undersöks. Dessa kristaller bildar små nålar runt 5 tusendels millimeter (5 mikrometer) tjocka och upp till 70 mikrometer långa, så att de stack ut från de producerande cellerna.
In-cellulokristallerna är så små att det krävs mycket ljusa röntgenstrålar för att analysera dem. Ju större en kristall är, ju fler atomer i den kan sprida röntgenstrålar, orsakar ett bättre diffraktionsmönster. Forskarna använde därför LCLS-röntgenlasern vid SLAC National Accelerator Laboratory i USA för analysen. "Röntgenlasrar genererar extremt intensiva blixtar, "förklarar Chapman, som är ledande forskare vid DESY i Center for Free-Electron Laser Science CFEL och en av talespersonerna för Cluster of Excellence CUI:Advanced Imaging of Matter. "Även om de känsliga kristallerna avdunstar omedelbart, de genererar först ett diffraktionsmönster från vilket strukturen kan erhållas. "Metoden som används här för att utnyttja dessa egenskaper, kallad seriell femtosekundkristallografi, utvecklades tidigare av många av forskarna som deltog i denna studie och utsågs till ett av årets tio bästa genombrott av Science magazine 2013.
Teamet registrerade diffraktionsmönstren på mer än 22, 000 mikrokristaller och kunde beräkna enzymets rumsliga struktur med en noggrannhet på 0,28 miljoner millimeter (nanometer) - detta motsvarar ungefär diametern på en aluminiumatom. "Resultatet visar inte bara enzymbrytarens exakta struktur, Bateman -regionen, men också vilka cellmolekyler som aktiverar omkopplaren och hur dessa så kallade samfaktorer binder till enzymomkopplaren, "rapporterar Karol Nass som utförde detta arbete under sina doktorandstudier vid DESY. Han arbetar nu vid Paul Scherrer -institutet i Schweiz och är, tillsammans med Redecke, huvudförfattare till publikationen.
Brytaren drivs av molekylerna adenosintrifosfat (ATP) och guanosinmonofosfat (GMP). "Fördelen med vår metod är inte bara att vi kan undersöka enzymet vid rumstemperatur, vid vilket enzymet fungerar naturligt, men också att under cellulokristallisation binder de naturliga ko-faktorerna till enzymet, "sa Betzel. Enligt forskaren, data kan nu ge ett tillvägagångssätt för att hämma parasitens IMP -dehydrogenas. "Man kan tänka sig att konstruera ett slags lås som täcker bindningsställena för båda kofaktorerna, till exempel."
Dock, en återstående utmaning är att designa IMP -dehydrogenashämmaren på ett så specifikt sätt att den blockerar parasitens enzym, men inte det mänskliga enzymet. Om detta är framgångsrikt, metoden kan eventuellt utökas till andra patogener, förklarar Betzel. "Andra parasiter har en mycket liknande struktur, och det kan också vara möjligt att attackera dem via respektive IMP -dehydrogenas. Enzymet är ett mycket intressant mål för läkemedel, till exempel mot rävbandmask eller elefantiapatogen. "
Universiteten i Hamburg, Lübeck och Tübingen, ryska vetenskapsakademien, Arizona State University, Lawrence Livermore National Laboratory i USA, Max Planck -institutet för medicinsk forskning, US National Accelerator Laboratory SLAC, Göteborgs universitet och DESY var inblandade i denna forskning.