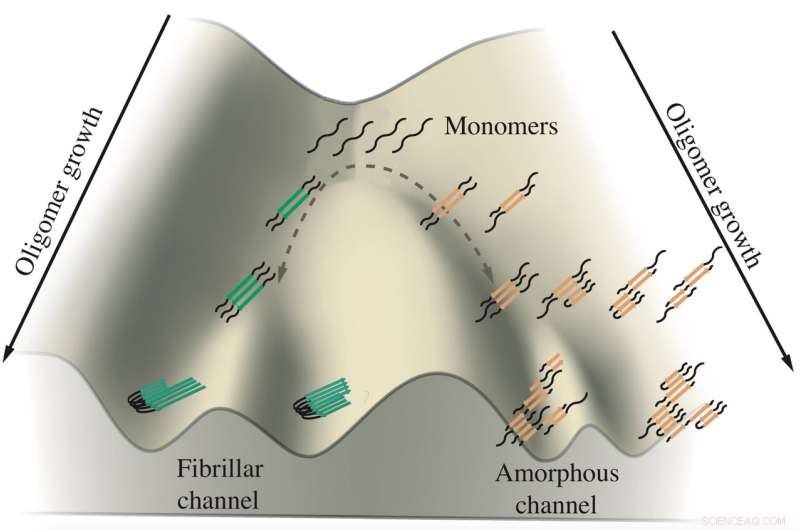
En schematisk bild visar tillväxten av tauoligomerer inblandade i Alzheimers och Picks sjukdomar. Monomerer av tau tenderar att aggregera längs två kanaler, en leder till fibriller som bildar tovor och den andra leder till amorfa klumpar i nervceller. Rice University-forskare simulerade proteinerna i beräkningsmodeller för att se hur och var förgreningen sker. Kredit:Centrum för teoretisk biologisk fysik
Nya simuleringar av forskare från Rice University berättar om två taus och hur de relaterar till neurologiska sjukdomar.
Deras arbete tyder på att tau-proteiner tar någon av två vägar för att bilda aggregat som misstänks främja, och kanske orsakar, Alzheimers och Picks (aka frontotemporal demens) sjukdomar. Exakt varför förblir ett mysterium, men att ta reda på det ger möjligheten att kontrollera deras öden.
Tau -proteiner, speciellt i neuroner, reglerar främst mikrotubuli, filamenten som fungerar som vägbanor för last inuti en cell och underlättar delning. Men de finns i många former och, som det visar sig, dessa kan aggregeras på olika sätt.
Studien av biofysikern Peter Wolynes och hans team i Förfaranden från National Academy of Sciences är den första beräkningsanalysen som gör en skillnad mellan proteiner som bildar antingen de fasta fibrillerna som finns i hjärnan hos patienter med Alzheimers och Picks eller störda, tumbleweed-liknande klumpar som flyter i neuronernas cytoplasma.
"Det finns ett samband mellan formen som förvandlas till membranlösa organeller (tumbleweeds) och formen som blir fibrer, sa Wolynes, en meddirektör för Rice's Center for Theoretical Biological Physics. "Det verkar finnas två distinkta vägar som samma tau-molekyl kan följa, och balansen mellan de två vägarna påverkas av någon biologisk process."
Han sa att modellerna tyder på att fosforylering, som reglerar många cellulära signaleringsprocesser, kan vara den avgörande faktorn.
"När vi tar reda på vilken av dessa aggregat som är den faktiska skurken, då borde det vara möjligt att ingripa i, säga, själva fosforyleringsprocessen för att ändra balansen, " sa Wolynes.
Rislabbet använde sitt grovkorniga AWSEM (associativt minne, vattenmedierad, struktur och energimodell) analysverktyg, som förutsäger hur proteiner viker sig, på en mängd olika tau-proteinmodeller baserade på varianter från patienter. De fann att bildandet av fibrer kan manipuleras genom fosforylering som sker på en mängd platser i tau-proteinet.
"Vi fann att fosforylering uppmuntrade bildandet av det amorfa aggregatet, men det uppmuntrade inte bildandet av fibern – lika mycket, i alla fall, Sa Wolynes.
Fosforylering kan också gå av stapeln, han sa. "Det finns ungefär 20 platser längs tau-proteinet som kan fosforyleras, men generellt, bara fyra eller fem av dem är, " sa Wolynes. "Men ibland, de har blivit hyperfosforylerade, vilket innebär att enzymerna som ansvarar för processen gör mer. De slutar med, säga, 10 platser fosforylerade istället för fem, och det kan ha en viss effekt.
"Om den extra fosforyleringen kan orsaka mer av sjukdomen, vi skulle vilja ta reda på vilka kinaser som gör fosforyleringen och försöka hämma dem med ett läkemedel, som vi gör vid behandling av cancer, " han sa.
Tau-proteiner uppvisade en annan intressant egenskap som kallas backtracking, vilket forskarna såg i amyloid beta-peptider som också är inblandade i Alzheimers. Båda tenderar att aggregera tills energiska hinder tvingar dem att delvis utvecklas och sedan söka en annan väg till deras sista, mest stabila former.
Det är vid den tidpunkten av frustration som aggregerande taus verkar förgrena sig i olika riktningar, sa Wolynes. En uppsättning tau bildar parallella fibriller som aggregerar till de ordnade plack som observeras i patienternas hjärnor, medan den andra löst aggregerar i den flytande klumpen. Forskarna föreslog att bakåtspårningsmekanismen kan vara en universell funktion i proteinaggregation, ett ämne för framtida studier.
De lösa aggregaten presenterar sina egna utmaningar för forskare, Sa Wolynes.
"De är en fysikfråga i följande mening:De är lokaliserade objekt, men varför inte alla bara glom ihop och bildar en enorm organell, som vad som händer med droppar olja i vatten?" sa han. "Är det bara så att det tar för lång tid för dem att röra sig? Är det så att de ständigt tillverkas och demonteras? Och vad avgör deras storlek?
"Vid denna punkt, det är fortfarande en mycket enkel och ganska enkel historia, "Sade Wolynes." Den faktiska historien om tau är fortfarande för komplicerad för oss, men det vi har lärt oss hittills är ganska okomplicerat."