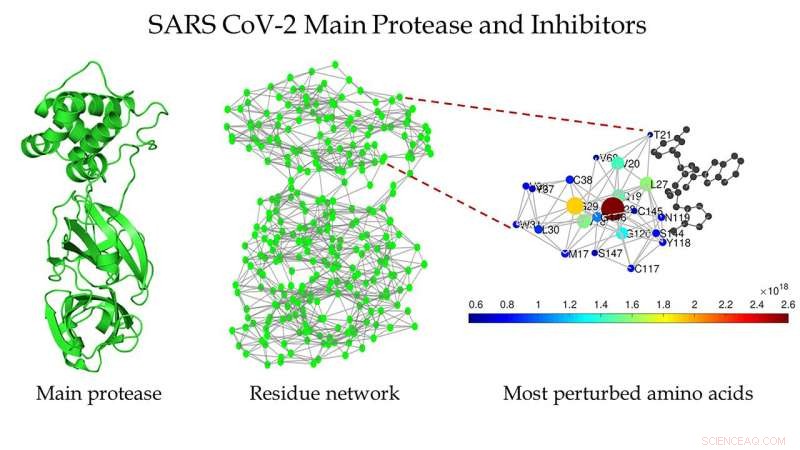
Schematisk över huvudproteaset av SARS CoV-2 (vänster), proteinrestnätverket för huvudproteaset av SARS CoV-2 (mitten), och en inzoomad vy av regionen runt bindningsstället som detekterats av Estrada (höger). Kredit:Ernesto Estrada
När covid-19-pandemin orsakad av coronaviruset SARS-CoV-2 fortsätter att spridas över världen, många forskare studerar epidemiologiska modeller för att förutsäga dess utbredning.
Dock, Ernesto Estrada, en matematiker och expert på komplexa system av ARAID Foundation vid University of Zaragoza, beslutade att fokusera på att hitta mål inom SARS-CoV-2 för nya läkemedel att attackera. Från tidigare arbete, han visste att virusets huvudsakliga proteas, ett enzym som ansvarar för proteolytisk bearbetning av polyproteiner, är ett utmärkt mål.
I journalen Kaos , Estrada sa när han och kollegor upptäckte en dramatisk ökning av känsligheten hos huvudproteaset av SARS-CoV-2 för små störningar, det fick dem att misstänka att det finns en roll för inhibitorer att spela för att döda viruset.
Inhibitorer är organiska molekyler, läkemedel, eller nya kemiska föreningar som fäster till ett proteas bindningsställe för att hämma dess arbete. Ett virus kommer att dö utan att ett proteolytiskt enzym fungerar för det.
"Jag märkte att kemister redan hade hittat några potenta hämmare av huvudproteaset av SARS-CoV-2, och att de hade löst strukturen av detta protein via röntgenkristallografi, " sa han. "Det var chockerande att se att detta proteas är mycket likt det för SARS-coronaviruset, som orsakade epidemierna 2003, SARS-CoV-1."
När forskare lade båda strukturerna ovanpå varandra, de matchade nästan perfekt.
"Om du radar upp aminosyrasekvenserna för båda proteaserna, det finns bara 12 av 306 rester som inte sammanfaller, ", sa Estrada. "Är det något gömt bakom dessa uppenbara likheter mellan de två proteaserna? Kan vi lära oss något av dem för att förbättra utformningen av läkemedel mot viruset?"
Estradas grupp har lång erfarenhet av analys av nätverk – som sociala nätverk, internet, eller näringskedjor mellan arter inom en miljö – och bestämde sig för att behandla ett protein som nätverk.
"De kallas proteinrestnätverk, där vi representerar varje aminosyra som en nod, och interaktionen mellan två aminosyror representeras av en länk mellan de två, " han förklarade.
De hittade flera strukturer av huvudproteaset av SARS CoV-1 och SARS CoV-2 som var rena, vilket betyder att de inte innehåller några mutationer, ligander, eller lösningsmedel i deras strukturer. De omvandlade sin struktur till nätverk av proteinrester.
Estrada sa att de flesta traditionella nätverksåtgärder avslöjade att båda strukturerna var väldigt lika varandra, något hans team redan visste. "Men för ett par år sedan, vi utvecklade ett mer sofistikerat matematiskt mått som gör att vi kan upptäcka hur långt bort en störning inom ett nätverk kan spridas. Det arbetet var av ett mycket teoretiskt, matematisk natur, men vi hade spekulerat i att det kunde vara användbart för studier av proteiner."
Så de satte det på prov. Det avslöjade att proteaset för SARS-CoV-2 är 1, 900 % känsligare för långväga överföring av störningar än proteaset från SARS-CoV-1.
"Detta betyder att när ett protein störs, till exempel av vatten i den intracellulära miljön, sådana störningar överförs genom ett nätverk av intrarester som bildar proteinets 3D-struktur, ", sa Estrada. "Om sådan störning produceras runt en given aminosyra i proteaset av SARS-CoV-1, det överförs bara genom en nära miljö runt den störda aminosyran."
Men om denna störning inträffar för en aminosyra i proteaset av SARS-CoV-2, det överförs till nästan hela nätverket – även till aminosyror väldigt långt borta.
"Det är anmärkningsvärt, eftersom det betyder att med små strukturella skillnader är proteaset av SARS-CoV-2 mycket effektivare inom kommunikation inom rester, ", sade Estrada. "Den bör vara mycket mer effektiv i att göra sitt jobb som ett proteolytiskt enzym av viruset. Djävulen gjorde ett nästan perfekt jobb här, men han lämnade dörren öppen. Denna stora känslighet hos SARS-CoV-2-proteaset för störningar kan vara dess akilleshäl i förhållande till inhibitorer."
Gruppens tillvägagångssätt kan användas för massiva screeningprotokoll för att identifiera potenta hämmare av SARS-CoV-2 huvudproteas och, följaktligen, för utvecklingen av nya läkemedel för att döda den.