
En ny studie från Princeton University och Sapienza University of Rome ger starka bevis för en kontroversiell teori att vid mycket kalla temperaturer kan vatten existera i två distinkta flytande former, den ena är mindre tät och mer strukturerad än den andra. Kredit:Foto av John Salatas, Creative Commons-licens
Vatten, så vanligt och så viktigt för livet, agerar på sätt som är ganska förbryllande för forskare. Till exempel, varför är is mindre tät än vatten, flyter istället för att sjunka som andra vätskor gör när de fryser?
Nu ger en ny studie starka bevis för en kontroversiell teori att vid mycket kalla temperaturer kan vatten existera i två distinkta flytande former, den ena är mindre tät och mer strukturerad än den andra.
Forskare vid Princeton University och Sapienza University of Rome genomförde datorsimuleringar av vattenmolekyler för att upptäcka den kritiska punkten där en vätskefas omvandlas till den andra. Studien publicerades i veckan i tidskriften Vetenskap .
"Närvaron av den kritiska punkten ger en mycket enkel förklaring till vattnets konstigheter, " sa Princetons dekan för forskning Pablo Debenedetti, klassen av 1950 professor i teknik och tillämpad vetenskap, och professor i kemi- och biologisk teknik. "Fyndet av den kritiska punkten motsvarar att hitta en vara, enkel förklaring till de många saker som gör vatten konstigt, speciellt vid låga temperaturer."
Vattens konstigheter inkluderar att när vattnet svalnar, det expanderar snarare än att dra ihop sig, vilket är anledningen till att fruset vatten är mindre tätt än flytande vatten. Vatten blir också mer klämbart - eller komprimerbart - vid lägre temperaturer. Det finns också minst 17 sätt på vilka dess molekyler kan ordna sig när de är frysta.
En kritisk punkt är ett unikt värde på temperatur och tryck där två faser av materia blir omöjliga att särskilja, och det inträffar precis innan materia förvandlas från en fas till en annan.
Vattens konstigheter förklaras lätt av närvaron av en kritisk punkt, sa Debenedetti. Närvaron av en kritisk punkt känns på ämnets egenskaper ganska långt bort från själva den kritiska punkten. Vid den kritiska punkten, kompressibiliteten och andra termodynamiska mått på hur molekylerna beter sig, såsom värmekapacitet, är oändliga.
Genom att använda två olika beräkningsmetoder och två mycket realistiska datormodeller av vatten, teamet identifierade den kritiska punkten för vätske-vätskor som låg i ett intervall på cirka 190 till 170 grader Kelvin (cirka -117 grader till -153 grader Fahrenheit) vid cirka 2, 000 gånger atmosfärstrycket vid havsnivån.
Upptäckten av den kritiska punkten är ett tillfredsställande steg för forskare som är involverade i den decennier gamla strävan att fastställa den underliggande fysiska förklaringen till vattnets ovanliga egenskaper. För flera decennier sedan, fysiker teoretiserade att kylning av vatten till temperaturer under fryspunkten samtidigt som det bibehålls som en vätska - ett "underkylt" tillstånd som inträffar i höghöjdsmoln - skulle exponera vattnets två unika flytande former vid tillräckligt höga tryck.
För att testa teorin, forskare vände sig till datorsimuleringar. Experiment med verkliga vattenmolekyler har hittills inte gett entydiga bevis på en kritisk punkt, delvis på grund av tendensen hos underkylt vatten att snabbt frysa till is.
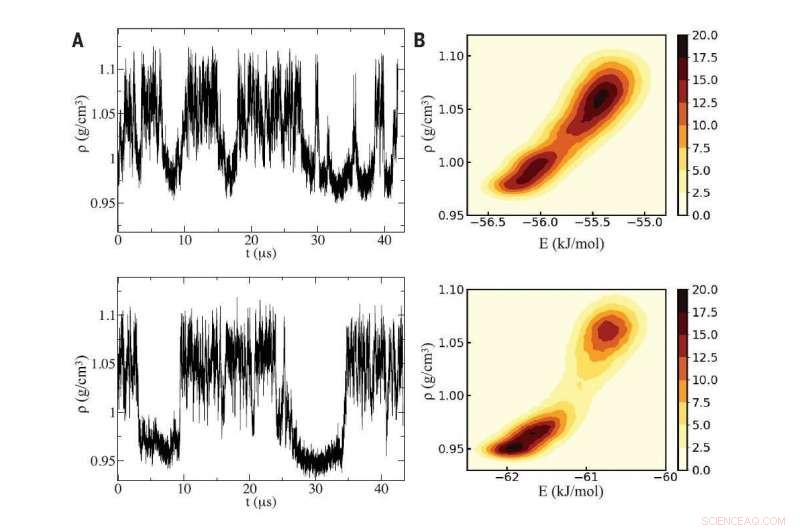
Fig A (vänster):Använd två distinkta datorsimuleringar av vatten (topp- och bottenpaneler), forskare upptäckte svängningar i densitet som är karakteristiska för underkylt vatten som pendlar mellan två vätskefaser som skiljer sig åt med densitet. Fig B (höger):Simuleringarna avslöjade en kritisk punkt mellan de två vätskefaserna, vars olika densiteter mikroskopiskt har sitt ursprung i intrånget av en extra vattenmolekyl i den lokala miljön av en generisk central molekyl i vätskan med hög densitet. Kredit:Återtryckt med tillstånd från PG Debenedetti et al, Vetenskap Vol 369 Issue 6501, DOI:10.1126/science.abb9796
Francesco Sciortino, professor i fysik vid Sapienza-universitetet i Rom, genomförde en av de första sådana modelleringsstudierna när han var postdoktor 1992. Den studien, publiceras i tidskriften Natur , var den första som antydde att det fanns en kritisk punkt mellan de två flytande formerna.
Det nya fyndet är extremt tillfredsställande för Sciortino, som också är medförfattare till den nya studien i Vetenskap . Den nya studien använde dagens mycket snabbare och kraftfullare forskningsdatorer och nyare och mer exakta modeller av vatten. Även med dagens kraftfulla forskningsdatorer, simuleringarna tog ungefär 1,5 års beräkningstid.
"Du kan föreställa dig glädjen när vi började se de kritiska fluktuationerna bete sig exakt som de skulle, " sa Sciortino. "Nu kan jag sova gott, för efter 25 år, min ursprungliga idé har bekräftats."
När det gäller de två flytande formerna av vatten, de två faserna samexisterar i obehaglig jämvikt vid temperaturer under fryspunkten och vid tillräckligt höga tryck. När temperaturen sjunker, de två vätskefaserna deltar i en dragkamp tills den ena vinner och hela vätskan blir lågdensitet.
I simuleringarna utförda av postdoktorn Gül Zerze vid Princeton och Sciortino i Rom, eftersom de sänkte temperaturen långt under fryspunkten till det underkylda området, vattnets densitet fluktuerade vilt precis som förutspått.
Vissa av vattnets udda beteenden ligger sannolikt bakom vattnets livgivande egenskaper, sa Zerze. "Livets vätska är vatten, men vi vet fortfarande inte exakt varför vatten inte kan ersättas med en annan vätska. Vi tror att orsaken har att göra med vattnets onormala beteende. Andra vätskor visar inte dessa beteenden, så detta måste kopplas till vatten som livets vätska."
De två faserna av vatten uppstår eftersom vattenmolekylens form kan leda till två sätt att packa ihop. I vätskan med lägre densitet, fyra molekyler samlas runt en central femte molekyl i en geometrisk form som kallas en tetraeder. I vätskan med högre densitet, en sjätte molekyl klämmer in, vilket har effekten att öka den lokala tätheten.
Teamet upptäckte den kritiska punkten i två olika datormodeller av vatten. För varje modell, forskarna utsatte vattenmolekylerna för två olika beräkningsmetoder för att leta efter den kritiska punkten. Båda tillvägagångssätten gav upptäckten av en kritisk punkt.
Peter Poole, en professor i fysik vid St. Francis Xavier University i Kanada, och en doktorand när han samarbetade med Sciortino och var medförfattare till 1992 års tidning i Nature, sa att resultatet var tillfredsställande. "Det är mycket tröstande att få det här nya resultatet, ", sa han. "Det har varit en lång och ibland ensam väntan sedan 1992 för att se ännu ett otvetydigt fall av en vätske-vätskefasövergång i en realistisk vattenmodell."
C. Austen Angell, Regents Professor vid Arizona State University, är en av pionjärerna av experiment på 1970-talet om underkylt vattens natur. "Ingen tvekan om att detta är en heroisk insats i simuleringen av vattenfysik med en mycket intressant, och välkommen, slutsats, sa Angell, som inte var involverad i denna studie, i ett mejl. "Som en experimentalist med tillgång till jämviktsmätningar (långsiktiga) fysiska mätningar på riktigt vatten, Jag hade alltid känt mig "säker" från företräde av datorsimulatorer. Men uppgifterna som presenteras i det nya dokumentet visar att detta inte längre är sant."