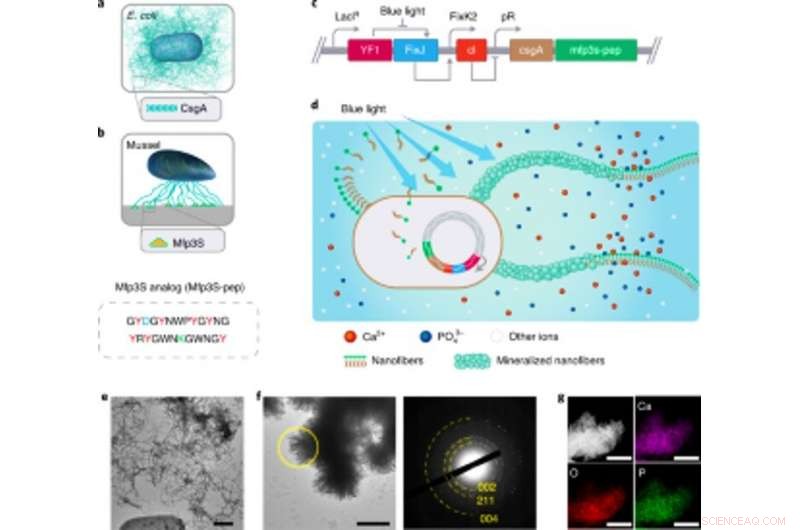
Engineering ljuskänsliga E. coli funktionella biofilmer som byggnadsställningar för HA mineralisering. Engineering ljuskänsliga E. coli funktionella biofilmer som byggnadsställningar för HA mineralisering. (a) Schematisk illustration av E. coli-biofilmer av vildtyp som omfattar extracellulära CsgA-amyloidnanofibrer, som är viktiga biofilmproteinkomponenter som bidrar till robust vidhäftning av biofilmer till fasta ytor. (b) Schematisk illustration av Mfps från klisterplacken från den kaliforniska musslan M. californianus. Mfp3S-pep (nedan) är en bioinspirerad adhesiv peptid som efterliknar det ursprungliga Mfp3S-proteinet som finns i de adhesiva placken hos M. californianus. Mfp3S-pep är berikad med asparaginsyra (blå), lysin (grön) och tyrosin (röd) rester, kända för sina funktionella roller för att främja kärnbildning, tillväxt och vidhäftning av HA. (c) Schematisk som visar de genetiska komponenterna i den ljuskänsliga E. coli-biofilmen. Designen av funktionella biofilmer möjliggjordes genom att fusionera sekvenser som kodar för CsgA-proteinet och Mfp3S-pep, båda placerade nedströms om det ljuskänsliga transkriptionskontrollelementet pDawn. I pDawn-kretsen, det konstitutiva uttrycket av histidinkinas YF1 och dess besläktade svarsregulator FixJ regleras hårt av LacIq-promotorn, medan expression av X-fagrepressorn cl kontrolleras av FixK2-promotorn. Vid blått ljus, kinasaktivitet av YF1 och därav följande uttryck av cI hämmas båda, vilket i sin tur aktiverar λ-promotorn pR för att främja uttrycket av CsgA–Mfp3S-pep. (d) Schematisk som visar lokal avsättning av HA-mineraler på de funktionella extracellulära nanofibrerna som består av CsgA-Mfp3S-pep-fusionsproteiner, utsöndras av konstruerad ljuskänslig E. coli, ljusmottagaren-CsgA–Mfp3S-pep-stammen. (e) TEM-bild som visar celler och extracellulär matris med rikligt med amyloidfibrer i biofilmerna. Skalstång, 500 nm. f, TEM-bild som visar de bildade kompositen och ribban-liknande kristallerna utfällda på ytorna av extracellulära nanofibrer efter 7 d av mineralisering i 1,5× SBF. Motsvarande SAED-mönster presenterar diffraktionsbågar tilldelade till (002), (211) och (004) plan. Skalstång, 500 nm. g, EDS-kartläggning som illustrerar Ca, O- och P-element i sig tilldelade HA-fasen. Skala staplar, 500 nm. Kreditera: Naturens kemiska biologi , doi:https://doi.org/10.1038/s41589-020-00697-z
Levande organismer har utvecklat mekanismer för biomineralisering för att bygga strukturellt ordnade och miljöanpassade kompositmaterial. Medan forskarlag har avsevärt förbättrat biomimetisk mineraliseringsforskning i labbet, det är fortfarande svårt att konstruera mineraliserade kompositer med strukturella egenskaper och levande komponenter ungefär som deras inhemska motsvarigheter. I en ny rapport som nu publiceras den Naturens kemiska biologi , Yanyi Wang och ett forskarlag inom fysik, avancerade material, syntetisk biologi, och ingenjörskonst i Kina, utvecklade levande mönstrade och gradientkompositer inspirerade av naturliga graderade material. De kopplade ljusinducerbar bakteriell biofilmbildning med biomimetisk hydroxiapatit (HA) mineralisering i detta arbete, för att visa hur platsen och graden av mineralisering kunde kontrolleras. Cellerna i kompositerna förblev livskraftiga medan de kände av och reagerade på miljösignaler. Kompositerna visade en 15-faldig ökning av Youngs modul (dvs. styvhet, förhållandet mellan stress och belastning) efter mineralisering. Arbetet kastar ljus för att utveckla levande kompositer med dynamisk lyhördhet och miljöanpassningsförmåga.
Biomineralisering i labbet
Levande organismer kan producera en mängd olika hierarkiska organisk-oorganiska sammansatta strukturer baserade på biomineralisering, där anmärkningsvärda exempel inkluderar de radulära tänderna hos chitoner, fiskfjäll och kräftkäkar som fyller olika biologiska funktioner. Tidpunkten och graden av biomineralisering måste kontrolleras exakt av celler för att bilda korrekta strukturer och funktioner i levande organismer. Ny forskning inom biomimetisk mineralisering har visat på vikten av att utforska cellkontrollerade metoder för att producera levande mönster och graderade kompositer som ett lovande men i stort sett outforskat område. Disciplinerna syntetisk biologi och materialvetenskap har släppt lös en rad sofistikerade och miljövänliga genkretsar för att biokonstruera en rad nya cellulära funktioner. I det här arbetet, Wang et al. utvecklat bioinspirerat, levande kompositmaterial genom att utnyttja ljusinducerbara Escherichia coli-biofilmer i kombination med biomimetisk mineralisering. Arbetet kommer att öppna dörrar för att integrera konstruerade celler för att producera mineraliserade material med strukturella och levande egenskaper.
Rumsligt kontrollerbar mineralisering av ljusinducerbara biofilmer för levande mönstrade kompositer. (a) Schematisk över experimentuppställningen och sekventiella steg för att producera levande mönstrade kompositer. Det blå bladmönstret som avbildas i illustrationen projicerades på en petriskål innehållande ljusmottagaren-CsgA-Mfp3S-pep-stammen suspenderad i medium. Blått ljus utlöser funktionell biofilmbildning genom det ljusreglerade uttrycket av CsgA–Mfp3S-pep-proteiner från lightreceiver-CsgA–Mfp3S-pep-stammen. Odlingsmediet i petriskålen ersattes sedan med 1,5× SBF, följt av inkubering vid 37°C för att bilda kompositer. Efter mineraliseringsprocessen, aTc tillsattes för att inducera uttrycket av ett rött fluorescerande protein (mCherry). (b) Digitalkamerabild av de mönstrade biofilmerna färgade med CV. Skalstång, 1 cm. (c) SEM-bilder som visar ytmorfologin hos de mönstrade biofilmerna. Skalstaplar:2 µm (vänster), 1 µm (höger). (d) Digitalkamerabild av den efterföljande mineraliserade kompositen som behöll det ursprungliga mönstret. Skalstång, 1 cm. (e) SEM-bilder som visar ytmikrostrukturerna hos den mineraliserade kompositen. Skalstaplar:2 µm (vänster), 1 µm (höger). (f, g) Konfokal laser scanning mikroskopi analys av bakteriell livsduglighet i biofilmer (f) och kompositer (g). Skala staplar, 5 µm. Observera att SYTO 9 färgämne och PI applicerades som märkningsmedel för att färga levande (gröna) och döda (röda) celler, respektive. (h) Inducerad fluorescens av den levande kompositen registrerad med ett ChemiDoc XRS-system. Skalstång, 1 cm. jag, Konfokalmikroskopi visade mCherry-uttryck från bakterierna i kompositen. Skalstång, 20 µm. j, Konfokala bilder av en levande komposit efter att ha inducerat mCherry-uttryck och märkning med calcein, vilket indikerade en homogen fördelning av organiska komponenter och oorganiska mineraler inuti de mönstrade levande kompositerna. Skala staplar, 20 µm. Kreditera: Naturens kemiska biologi , doi:https://doi.org/10.1038/s41589-020-00697-z 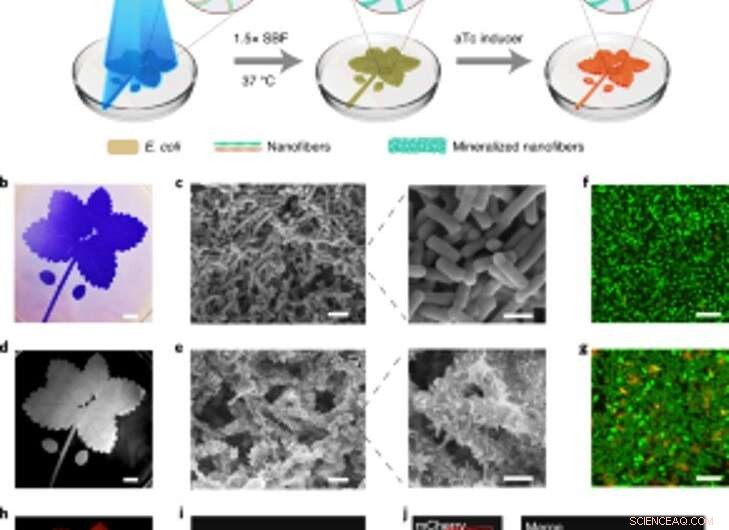
Teamet valde fusionsproteiner för att skapa mineralisering som främjar E. coli-biofilmer. Baserat på tidigare experiment, de valde proteinet Mefp5 – som kommer från Mytilus edulis, följt av Mfp3S – med ursprung från Mytilus californianus och en annan variant av Mfp3S-peptiden (Mfsp3S-pep) för att initiera mineralisering och främja vidhäftning. Teamet konstruerade fusionsproteiner innehållande en viktig proteindomän av E. coli-biofilmen för att bilda CsgA-Mfp-fusionsproteiner och bekräftade deras potentiella utsöndring från konstruerade celler. De valde sedan CsgA-Mfp3S-pep-fusionsproteinet som en representant för hydroxiapatitmineralisering och genomförde experiment för att verifiera proteinets funktion för att framhäva deras roll under mineralisering och kristallbildning. Därefter, Wang et al. konstruerade en ljusinducerbar biofilmbildande stam som heter light mottagare -CsgA-Mfp3S-pep som kan regleras hårt via blåljusbelysning.
Den ljuskänsliga stammen kan generera funktionella biofilmmaterial efter belysning med ljus för att främja mineraliseringen av hydroxiapatit (HA). För att bekräfta detta, forskarna exponerade den ljuskänsliga stammen för blått ljus i en petriskål och använde histologisk färgning och transmissionselektronmikroskopi (TEM) för att visa produktionen av amyloidfibrer i biofilmerna. Jämförelsevis, de observerade inte amyloidfibrer i prover odlade i mörker. Den konstruerade extracellulära matrisen fungerade också som en mall för HA-mineralisering i tid, vilket de bekräftade efter 7 dagars inkubation baserat på tekniker för röntgendiffraktion (XRD) och energidispersiv röntgenspektroskopi (EDS).
Densitetskontrollerbar mineralisering i ljusintensitetsreglerade gradientbiofilmer som används för att tillverka levande graderade kompositer. (a) Schematisk illustration som visar genereringen av levande gradientkompositer genom in situ mineralisering av biofilmer med gradientbiomassadensiteter. Gradientbiofilmerna bildades genom att projicera ljus med varierande intensitet och exakt rumslig kontroll på petriskålen innehållande ljusmottagaren-CsgA-Mfp3S-pep-stammen suspenderad i medium. (b) Digitalkamerabild som visar CV-färgade biofilmer med gradientbiomassadensiteter. Skalstång, 1 cm. (c) Digitalkamerabild av efterföljande bildade gradient levande kompositer efter HA-mineralisering. Skalstång, 1 cm. (d) Tjockleken på biofilmer och de efterföljande mineraliserade kompositerna som bildas under olika ljusintensiteter. Resultaten presenteras som medel ± s.d. Data är representativa för n= 5 oberoende experiment. (e) Sektions-SEM-mikrofotografier som visar morfologierna för olika regioner (A1–A4) i de ljusintensitetsgraderade biofilmerna. Skala staplar, 10 µm. Den infällda bilden (tagen från A4-området) representerar den typiska ytmorfologin för biofilmer. Skalstång, 1 µm. (f) Sektions-SEM-mikrofotografier som visar morfologierna för olika regioner (B1–B4) i de levande gradientkompositerna som mall av ljusintensitetsgraderade biofilmställningar. Skala staplar, 10 µm. Den infällda bilden (tagen från B4-regionen) representerar den typiska ytmorfologin för de mineraliserade gradientkompositerna. Skalstång, 1 µm. Observera att opacitetsprocenten på 100 %, 50 %, 25 % och 12,5 % motsvarar faktiska ljusintensiteter på 0,0306 W cm−2, 0,0268 W cm−2, 0,0178 W cm−2 och 0,0140 W cm−2, respektive. Kreditera: Naturens kemiska biologi , doi:10.1038/s41589-020-00697-z 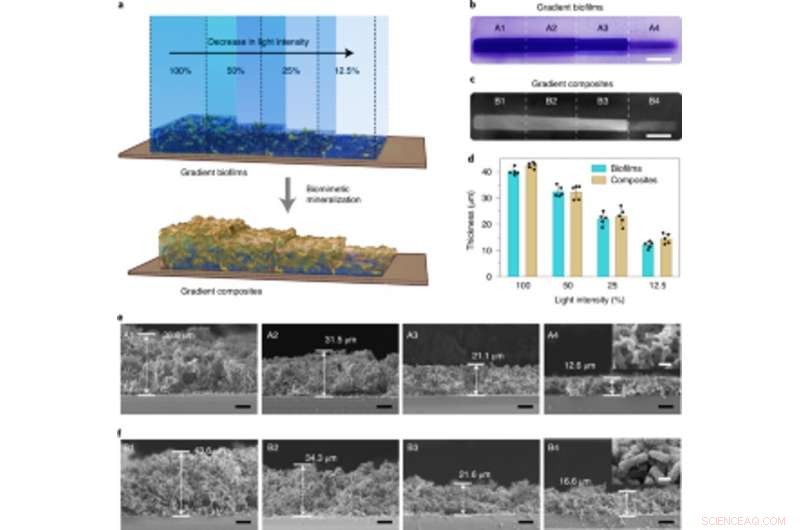
Baserat på den ljuskänsliga naturen hos de konstruerade biofilmerna, Wang et al. manipulerad biofilmbildning i rum-tid för att kontrollera bildningen av kompositer. De åstadkom detta genom att belysa ett bladmönster på flytande bakteriekulturer i petriskålar av polystyren som troget recapitulerade det projicerade ljusmönstret på de bakteriella biofilmerna. Efter 7 dagars mineralisering, kompositen som genererades i petriskålarna behöll det ursprungliga mönstret som observerats med användning av svepelektronmikroskopi. Det ljusreglerade tillvägagångssättet styrde formen på kompositen baserat på rutmönsterprojektioner och rumslig upplösning av ljus i mikroskalan - jämförbar med storleken på de levande bakterierna. Teamet verifierade sedan livsdugligheten för live, intakta celler genom att konstruera de levande kompositerna för att uttrycka fluorescerande proteiner, som bekräftats med konfokalmikroskopibilder. Därefter, de använde termogravimetrisk analys för att kvantifiera de oorganiska komponenterna i mineraliserade kompositer, där det oorganiska materialet ökade proportionellt med tiden vid nedsänkning i simulerad kroppsvätska (SBF). Wang et al. jämförde också Youngs modul för biofilmen med hjälp av en mikroindragningsteknik för att visa hur mineralisering stärkte E. coli-biofilmerna för att skydda cellerna.
Densitetskontrollerade gradientkompositer
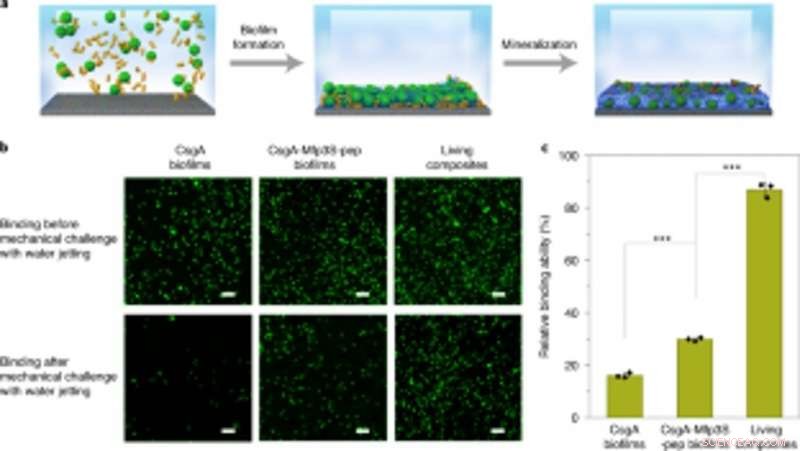
Koppling av konstruerade biofilmer med mineralisering för robust infångning och immobilisering av mikrosfärer på substrat. (a) Schematisk bild som visar infångningen och immobiliseringen av mikrosfärer på ett objektglas i lösning. PS-mikrosfärer suspenderade i odlingsmedium infångades och immobiliserades på ett substrat genom biofilmbildning följt av mineralisering i 1,5× simulerad kroppsvätska (SBF). (b) Fluorescerande bilder som visar de två typerna av biofilmer (vänster och mittpelare) och levande komposit-immobiliserade mikrosfärer (höger kolumn) på substraten före (överst) och efter (botten) utmaning med vattenstrålning vid ett konstant utsläppstryck på 8 psi. Skala staplar, 100 µm. (c) Kvantifiering av den relativa förmågan hos olika biofilmer och levande kompositer att limma och immobilisera PS-mikrosfärer på substratet. Resultaten presenteras som medel ± s.d. Från vänster till höger:P= 0,00003, P= 0,000004. *P < 0,05, **P < 0,01, ***P < 0,001. Statistik härleds med hjälp av ett tvåsidigt t-test. Data är representativa för n= 3 oberoende experiment. Kreditera: Naturens kemiska biologi , doi:https://doi.org/10.1038/s41589-020-00697-z
Vävnadstekniska tillvägagångssätt har betonat behovet av att exakt identifiera mellan hårda och mjuka vävnader för framgångsrik fysiologisk prestation, därför kan ljusintensiteten justeras för att kontrollera densiteten och de mekaniska egenskaperna hos konstruerade levande material. Zhang et al. åstadkom detta genom att exponera E. coli-kulturer för olika belysningsintensiteter för att avslöja hur biofilmtjockleken minskade med den minskande intensiteten av blått ljus. De visade vidare hur mineraliseringen var tätt och lokalt styrd av de konstruerade Mfsp3S-pep-fusionsproteinerna. Sedan studerade de de lokala mekaniska egenskaperna hos belysta regioner med mikroindragning för att observera en fyrfaldig ökning av Youngs modul för att lyfta fram levande kompositer konstruerade med avstämbara mineralgradienter och mekaniska egenskaper för regenerativa gränssnitt mellan vävnad och ben i benvävnadstekniska tillämpningar.
Utplacering av levande kompositer för platsspecifik skadereparation
Forskarna studerade också kapaciteten för de konstruerade biofilmerna att aggregera för skadereparation genom att limma polystyrenmikrosfärer, vid sidan av HA-mineralisering. Som proof-of-concept, de applicerade levande mineraliserade kompositer för att fylla och reparera sprickor konstruerade på ytan av en petriskål av polystyren. Under experimenten, de ljusinducerade självhäftande biofilmerna fångade mikrosfärer i lösning för att fylla den avsiktligt skapade skadade fåran, medan nanofibrer i biofilmer fungerade som en mall för hydroxiapatitmineralisering för att konsolidera ljusinducerad cementering under blått ljus. Med hjälp av svepelektronmikroskopi, Wang et al. visade hur bakterier och den omgivande extracellulära matrisen fäste ihop med mikrosfärer för att illustrera den vidhäftande funktionen hos de levande biofilmerna. De HA-mineraliserade kompositerna bildades täta, betongliknande lager som filade den skadade fåran för att markera mineraliseringsfunktionaliteten hos de levande kompositerna för förbättrad hållbarhet och reparationsapplikationer.
Tillämpning av kontrollerbar levande mineralisering för platsspecifika skadereparationer. (a) Schematisk beskrivning som visar applicering av levande mineraliserade kompositer för att fylla och reparera sprickor på ytan av en PS petriskål. Från vänster till höger:skada fåran på petriskålens substrat, ljusinducerade självhäftande biofilmer fångar mikrosfärer i lösning för att fylla den skadade fåran, och nanofibrer i biofilmer fungerar som en mall för HA-mineralisering för att konsolidera cementen. (b) SEM-bild som visar skadefåran. Nedan, ett schematiskt diagram som illustrerar dimensionerna på skadefåran. Skalstång, 50 µm. c, SEM-bilder som visar morfologin hos den skadade fåran fylld med biofilmen och mikrosfärerna. Skalstaplar:50 µm (överst), 5 µm (botten). (d) SEM-bilder som visar morfologin hos skadefåran efter mineralisering; HA fyller i luckorna mellan sfärerna. Skalstaplar:50 µm (överst), 5 µm (botten). Observera att de platsspecifika skadereparationsexperimenten upprepades minst tre gånger med identiska resultat. Kreditera: Naturens kemiska biologi , doi:10.1038/s41589-020-00697-z 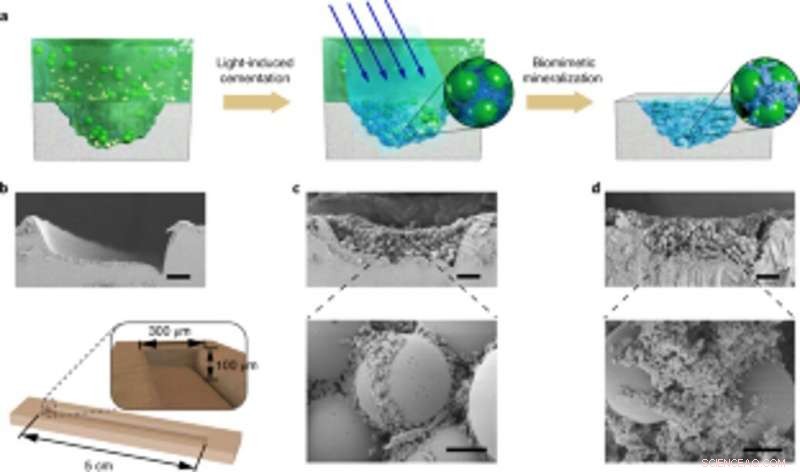
På det här sättet, Yanyi Wang och kollegor producerade bioinspirerade levande mönstrade kompositer och levande graderade kompositer med en ljusreglerad biofilmplattform. De resulterande kompositerna visade en miljökänslighet som liknar deras inhemska motsvarigheter. Cellerna i kompositerna förblev livskraftiga och svarade på miljöstimuli även efter mineralisering. Verket öppnar en väg för att skapa boende, funktionella organisk-oorganiska kompositer med adaptiva och självreparerande egenskaper med tillämpningar inom biomedicin, regenerativ medicin, och biosanering.
© 2020 Science X Network