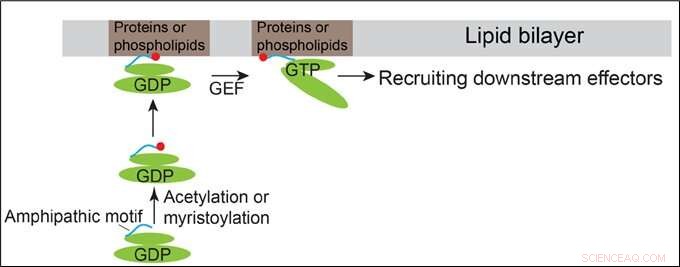
Modell som visar hur Arfrp1 och Arl14 rekryteras till membranen. Kredit:HKUST
De små GTPaserna i familjen ADP-ribosyleringsfaktor (Arf) är nyckelinitiatorer till olika fysiologiska processer inklusive utsöndring, endocytos, fagocytos och signaltransduktion. Arf-familjens proteiner fungerar för att förmedla rekrytering av cytosoliska effektorer till specifika subcellulära avdelningar. Denna process underlättar Arf -effektorer för att utföra lastigenkänning, lipidmodifiering eller andra cellulära funktioner.
Blockering av aktiviteterna hos proteiner från Arf-familjen hämmar utsöndringen av viktiga molekyler från cellen och hämmar även cellulärt upptag av näringsämnen. Defekter i Arfs eller deras regulatoriska proteiner är relaterade till olika ärftliga sjukdomar, inklusive X-länkad intellektuell funktionsnedsättning (XLID), Jouberts syndrom, Bardet-Biedl syndrom och cilia dysfunktion. Således, Att studera molekylära mekanismer för Arf-reglerade intracellulära aktiviteter representerar en möjlighet att förstå dessa sjukdomars etiologi och utveckla nya terapeutiska strategier.
Arf-familjens proteiner kretsar mellan ett GDP-bundet inaktivt tillstånd och ett GTP-bundet aktivt tillstånd. De har liknande strukturella organisationer som innehåller ett N-terminalt amfipatisk helixmotiv och switchdomänerna. Switchdomänerna för Arf-proteiner binder direkt deras motsvarande guanidinnukleotidbytesfaktorer (GEF), vilket gör det möjligt för Arf-proteiner att binda GTP. Det är allmänt tänkt att membranrekrytering av Arf-proteiner initieras av GTP-bindande inducerade konformationsförändringar av Arf-proteiner.
Förutom denna konventionella mekanism, Prof Guo och hans team upptäckte att de N-terminala amfipatiska motiven hos det Golgi-lokaliserade Arf-familjens protein, Arfrp1, och det endosom- och plasmamembranlokaliserade Arf-familjens protein, Arl14, är tillräckliga för att bestämma specifika subcellulära lokaliseringar på ett GTP-oberoende sätt. Utbyte av de amfipatiska helixmotiven mellan dessa två Arf-proteiner orsakar byte av deras lokaliseringar. Den rumsliga bestämningen som förmedlas av Arfrp1-helixen kräver dess bindande partner Sys1. Dessutom, studien indikerar att acetyleringen av Arfrp1-helixen och myristoyleringen av Arl14-helixen är viktiga för den specifika subcellulära lokaliseringen. En föreslagen modell representerar membranrekryteringen av Arfrp1 och Arl14.
Denna studie avslöjar nya insikter i det molekylära maskineriet som reglerar membranassociation av vissa Arf-proteiner, vilket tyder på att membranassociationen och aktiveringen av vissa Arf -proteiner är frånkopplad. Denna studie erbjuder också nya korta motiv för att rikta proteiner till specifika intracellulära lokaliseringar.
Resultaten publicerades nyligen i den vetenskapliga tidskriften Journal of Biological Chemistry .