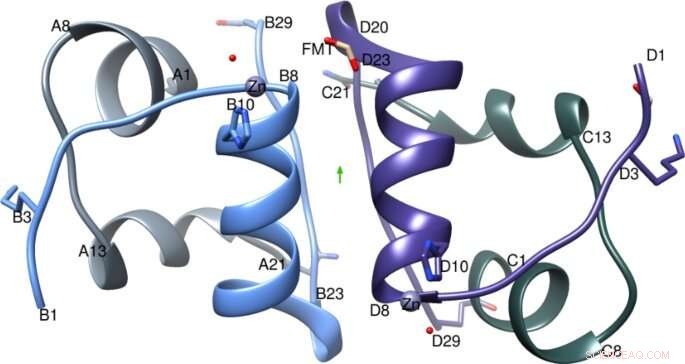
IGlu dimer med den tvåfaldiga axeln (grön pil), A-kedjan är färgad ljusgrå, B-kedja i ljusblått, C-kedja i mörkgrå och D-kedja i lila. Figur skapad med Chimera v1.8.1 cgl.ucsf.edu/chimera/. Kreditera: Vetenskapliga rapporter (2021). DOI:10.1038/s41598-021-81251-2
För första gången, Forskare har kommit med en exakt förklaring på atomnivå till varför glulisin - ett vanligt använda läkemedel för att behandla diabetes - verkar snabbare än insulin.
Resultaten, publiceras idag i Vetenskapliga rapporter , skulle kunna ha fördelar för diabetespatienter genom att säkerställa att ett mer förbättrat insulin kan utvecklas för framtida behandling.
Studien utfördes av experter från universiteten i Nottingham och Manchester och Imperial College London, tillsammans med Diamond Light Source – Storbritanniens nationella synkrotronforskningsanläggning.
Glulisine är ett syntetiskt snabbverkande syntetiskt insulin som utvecklats av Sanofi-Aventis - med varumärket Apidra. Det används för att förbättra blodsockerkontrollen hos vuxna och barn med diabetes.
I denna nya studie, forskare försökte fastställa den exakta strukturen av gluisin, och hur denna struktur kan påverka det sätt på vilket den beter sig fysiologiskt.
Teamet syftade till att etablera, genom att undersöka strukturen, vilken grundläggande roll gluisin spelar i diabeteshantering. Dessa fynd kan potentiellt leda till ett förbättrat syntetiskt insulin för patienter, med färre biverkningar.
Dr. Gary Adams docent och läsare i tillämpad diabeteshälsa vid University of Nottingham, och huvudförfattare till studien, sa:"För första gången, vår forskning ger nya, strukturell information om ett kliniskt relevant syntetiskt insulin, glulisin, vilket är en viktig behandling för de patienter med diabetes.
"Denna information belyser dissociationen av glulisin och kan förklara dess snabba dissociation till dimerer och monomerer och därmed dess funktion som ett snabbt verkande insulin. Denna nya information kan leda till en bättre förståelse av det farmakokinetiska och farmakodynamiska beteendet hos glulisin och, i tur och ordning, kan hjälpa till att förbättra dess formulering och minska biverkningar av detta läkemedel."
För att genomföra forskningen, teamet skapade en perfekt kristall av glulisin. Forskarna använde sedan en kombination av metoder för att ge en detaljerad inblick i glulisins struktur och funktion.
Dr Hodaya Solomon, en medlem av Imperial College-teamet, och gemensam förstaförfattare sa:"De viktigaste molekylära jämförelserna mellan denna kristallstruktur av glulisin och tidigare insulinkristallstrukturer visade att en unik position för glutaminsyran (en aminosyra), finns inte i andra snabbverkande analoger, pekade inåt snarare än mot utsidan. Detta minskar interaktioner med närliggande molekyler och ökar därför preferensen för den mer aktiva-för-patienter dimerform, ge experterna en bättre förståelse för glulisins beteende."
John Helliwell, Emeritus professor i kemi vid University of Manchester, och en av författarna till tidningen, sa:"Ett oväntat fynd var att glulisinformuleringen är dokumenterad som en zinkfri insulinanalog för dess snabba absorptionsverkan. Insulinkristallografi har visat att zink är avgörande för hexamerbildning. Den nya glulisinkristallstrukturen visade zink bundet på samma sätt som i naturligt insulin, av tre histidinaminosyror. Detta fynd måste innebära att spår av zinkjoner finns i den kommersiella, som levereras, formuleringslösning. En ytterligare optimering för glulisin är nu klar, att äntligen ta bort zinken."