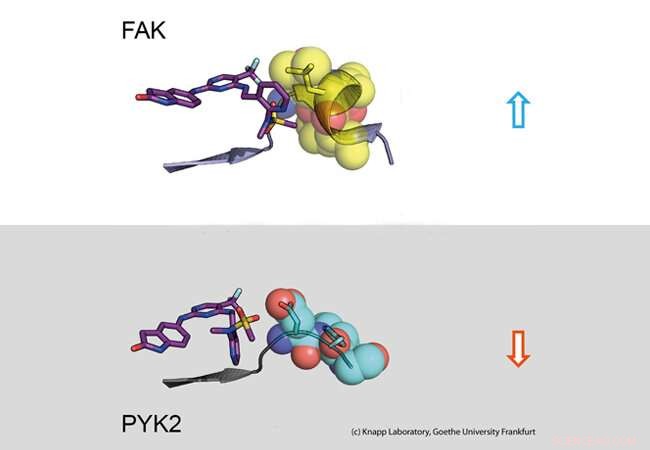
Övre del:Lång uppehållstid. En inhibitor (vänster:stickmodell) binder till signalmolekylen FAK (höger:en del av FAK-proteinet avbildat som kalottmodell med sfärer). Den strukturella förändringen av FAK orsakar hydrofoba kontakter (gul, så kallat DFG-motiv) och ett långvarigt engagemang. Nedre del:Kort uppehållstid. PYK2-signalprotein ändrar inte sin struktur vid inhibitorbindning, vilket resulterar i en snabb inhibitordissociation. Kredit:Knapp Laboratory, Goethe-universitetet i Frankfurt
Många anticancerläkemedel blockerar signaler i cancerceller som hjälper degenererade celler att föröka sig okontrollerat och lossna från vävnaden. Till exempel, blockerar signalproteinet FAK, ett så kallat kinas, gör att bröstcancerceller blir mindre rörliga och därmed mindre benägna att metastasera. Problemet är att när FAK blockeras av en inhibitor, det närbesläktade signalproteinet PYK2 blir mycket mer aktivt och tar därmed över en del av FAK:s uppgifter. Idealet vore därför en hämmare som hämmar både FAK och PYK2 på samma sätt så länge som möjligt.
Ett internationellt team under ledning av läkemedelskemisten Prof. Stefan Knapp från Goethe-universitetet har undersökt en serie speciellt syntetiserade FAK-hämmare. Alla inhibitorer band till FAK-proteinet med ungefär samma hastighet. Dock, de skilde sig åt i bindningstiden:Den mest effektiva inhibitorn förblev bunden till FAK-signalproteinet längst.
Med hjälp av strukturella och molekylärbiologiska analyser samt datorsimuleringar, forskargruppen upptäckte att bindning av inhibitorer som finns kvar i FAK-bindningsfickan under lång tid framkallar en strukturell förändring. Således, genom bindning av dessa hämmare, FAK ändrar form och bildar en specifik, vattenavvisande struktur vid kontaktplatser med inhibitorn, jämförbar med en intim famn.
Det närbesläktade proteinet PYK2, å andra sidan, förblev förhållandevis stel, och även om den mest effektiva FAK-hämmaren också blockerade PYK2, dess effekt var betydligt svagare på grund av snabbt dissocierande inhibitorer från bindningsstället. Intressant, datorsimuleringar kunde förutsäga kinetiken för bindning mycket bra, tillhandahålla en metod för noggrann simulering av läkemedelsdissociationshastigheter för framtida optimering av läkemedelskandidater.
Prof. Stefan Knapp förklarar, "Eftersom vi nu har en bättre förståelse för de molekylära mekanismerna för interaktionen mellan potenta hämmare av dessa två kinaser, vi hoppas kunna använda datorsimuleringar för att bättre förutsäga läkemedelsuppehållstider för inhibitorer och läkemedelskandidater i framtiden. Än så länge, liten uppmärksamhet har ägnats åt läkemedelsbindningens kinetiska egenskaper. Dock, denna egenskap har nu dykt upp som en viktig parameter för utvecklingen av mer effektiva läkemedel som är designade för att hämma deras målproteiner – som i fallet med FAK och PYK2 – inte bara kraftfullt utan också under lång tid."