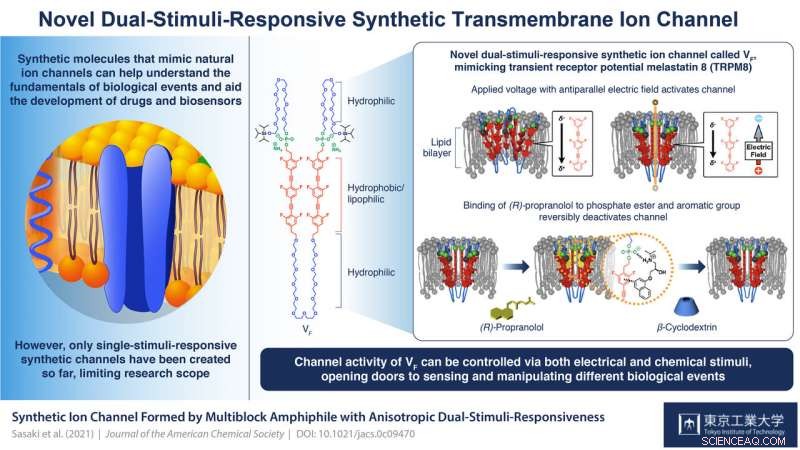
En multiblock amfifil VF utvecklades. När VF införlivades i lipiddubbelskiktsmembranen, VF bildade en supramolekylär jonkanal. Jontransportegenskapen hos VF skulle kunna ändras reversibelt genom tillsats av (R)-propranolol, en aromatisk amin känd som ett antiarytmiskt medel, följt av tillsats av p-cyklodextrin för dess avlägsnande. Kredit:Tokyo Tech
Forskare vid Tokyo Institute of Technology (Tokyo Tech) och University of Tokyo, Japan, ha, för första gången, syntetiserade en ny artificiell transmembranjonkanal modellerad på en naturligt funnen transmembrankanal involverad i neuronsignalering - som svarar på både kemiska och elektriska stimuli. Med tanke på dess övergripande egenskaper, denna konstgjorda kanal öppnar dörrar till ny grundläggande forskning om cellulär transport och signalering, nya möjligheter inom läkemedelsutveckling, och potentialen för nya typer av biosensorer.
En nyckeltråd som håller ihop den känsliga balansen i ett komplext biologiskt system är den transmembrana jonkanalen. Dessa är supramolekylära, eller multimolekyl, jon- och molekylbytesvägar inbäddade i cellmembran för att säkerställa väsentlig kemisk transport till och från cellen och underlätta cellsignalering.
På senare år har syntetiska biomolekyler som efterliknar strukturerna och funktionerna hos naturliga jonkanaler har väckt stort intresse bland molekylärbiologiska forskare som modeller för att studera grunderna för dessa kanaler och kanske, till och med skapa läkemedelsalternativ eller utveckla avancerade biosensorer.
Dock, även om flera bra syntetiska jonkanaler har utvecklats, de flesta av dem aktiveras endast via en enda stimulans och ingen är vad forskarna kallar "anisotropisk dubbelstimuli-responsiv, " eller sådana som kan aktiveras och kontrolleras av två specifika typer av stimuli beroende på den partiska orienteringen av strukturen inuti membranet. Detta har begränsat forskningsutrymme på området.
Nu, till sist, en grupp forskare från Tokyo Tech och University of Tokyo, Japan, har framgångsrikt syntetiserat en biomolekyl som liknar en naturlig anisotropisk dubbel-stimuli-responsiv kanal:transient receptor potential melastatin 8 (TRPM8), som ligger till grund för signalöverföringar i neuroner. Deras kanal heter VF och deras genombrott publiceras i Journal of the American Chemical Society .
VF är en multiblock amfifil (den har både vattenälskande (hydrofila) och fettälskande (lipofila) egenskaper) molekyl som kan samlas för att bilda supramolekylära kanaler. Varje enhet i ett block innefattar en organisk lipofil/hydrofob del med sex fluoridatomer som placerar den inom cellmembranets lipiddubbelskikt och ger den en elektrisk polaritet; en fosfatestergrupp som säkerställer att strukturen är förspänd i sin orientering (med fosfatsidan mot det extracellulära utrymmet); och flexibla hydrofila etylenglykolkedjor mellan hydrofoba enheter och på ändarna som bidrar till stimuli-känsligheten.
Forskarnas studier av denna struktur visade att genom att manipulera polariteterna och amplituderna för pålagda spänningar, kanalen kunde aktiveras. Prof. Kazushi Kinbara, ledande forskare i laget, förklarar:"Utan applicering av en spänning, de hydrofoba enheterna av VF stöter bort varandra så att de skulle vara rumsligt separerade från varandra och inte skulle bilda klara och funktionella transmembranjonkanaler. När en spänning med den elektriska fältvektorn antiparallell med den elektriska polariteten hos VF påläggs, en förskjutning av elektronfördelning inom VF inträffar, försvagar avstötningen mellan hydrofoba enheter och förbättrar deras stapling ansikte mot ansikte. Detta orsakar konformationsförändringar genom hela molekylen vilket leder till bildandet av supramolekylära kanaler som effektivt kan transportera joner över membranet."
Forskarna fann att den andra stimulansen hade att göra med bindningen av ligand (R)-propranolol vid kopplingen mellan fosfatestrarna och de hydrofoba enheterna. Som prof. Kinbara förklarar, "(R)-propranolol är ett antiarytmiskt medel känt för att blockera spänningsstyrda natriumkanaler. Dessutom, våra tidigare studier indikerade att det interagerar med fosfatestergrupper och aromatiska enheter för att lokaliseras inuti kanalens porer och blockera jontransport. Det är därför vi valde det för vår studie." Deras kärnmagnetiska resonansspektroskopi avslöjade dess bindning vid fosfatställena, och att det helt hämmar strömflödet och därmed jonkanalaktiviteten hos VF. Dess avlägsnande via tillsats av β-cyklodextrin reaktiverar kanalen. "Reversibel ligandbindning som denna är nyckeln till att upprätthålla homeostas i kroppen via regleringen av transmembrana jonkanaler. Den mycket reglerade orienteringen av VF möjliggjorde detta anisotropa svar på denna ligandmolekyl, " Prof. Kinbara säger. "Med vår framgång i denna studie, det finns nu stor potential för att känna av och manipulera olika biologiskt viktiga händelser."
Verkligen, med syntesen av VF, lämpad för de variabla cellulära miljöer som finns allestädes närvarande i biologiska system, kanske, nya möjligheter för forskning växer fram inom området molekylärbiologi.