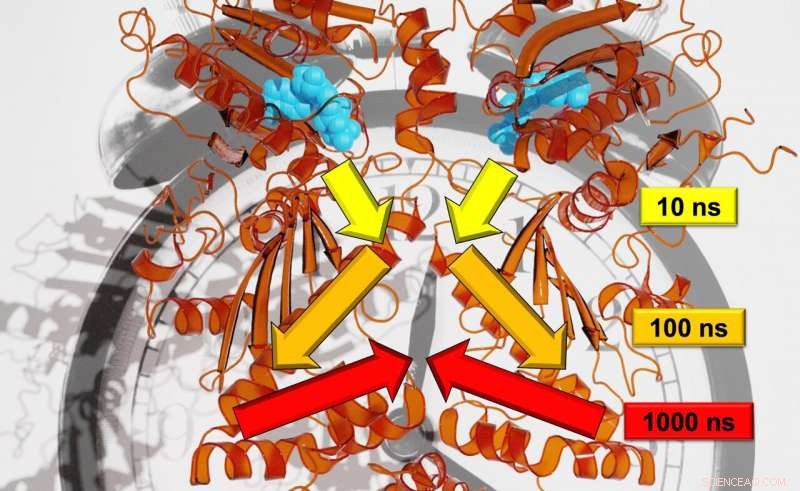
Forskare från Freiburg har kunnat analysera den exakta signalöverföringshastigheten över flera tidsskalor. Upphovsman:Steffen Wolf
Tänk ett ögonblick på ett träd som svajar i vinden. Hur lång tid tar det för rörelsen av en kvist att nå trädets stam? Hur överförs denna rörelse egentligen genom trädet? Forskare vid universitetet i Freiburg överför denna typ av frågor till analys av proteiner - som är cellens molekylära maskineri.
Ett team av forskare ledd av prof. Dr. Thorsten Hugel från Institute of Physical Chemistry, och Dr Steffen Wolf och prof. Dr Gerhard Stock vid Institute of Physics undersöker hur signalerna som orsakar strukturella förändringar i proteiner rör sig från en plats till en annan. De försöker också avgöra hur snabbt dessa mekanismer sker. Tills nu, forskare har inte kunnat analysera den exakta signalöverföringshastigheten eftersom den involverar många tidsskalor - allt från nanosekunder till sekunder. Forskarna i Freiburg, dock, har nu uppnått en sådan upplösning genom att kombinera olika experiment, simuleringar, och teoretiska studier. De publicerar sina resultat i den vetenskapliga tidskriften Kemisk vetenskap .
I motsats till träd, rörelserna för proteinet som analyserades i studien, Hsp90, utvecklas på logaritmiska tidsskalor. Varje stor rörelse tar ungefär tio gånger så lång tid som den lilla, enskilda rörelser som utgör den större. Wolf förklarar, "Till exempel, en kvist rör sig på en tidsskala på sekunder; grenen med tio sekunder; och stammen med 100 sekunder. "Med hjälp av en kombination av toppmoderna experimentella och teoretiska metoder gjorde forskarna möjligt att övervaka allosterisk kommunikation, med andra ord, för att visa hur en reaktionsprocess i Hsp90 förändrade ett avlägset proteinbindningsställe. Enligt Stock, laget upptäckte den hierarki av dynamik som denna allosteriska process utspelar sig på, som inkluderar nanosekund till millisekund tidsskalor och längdskalor från pikometrar till flera nanometrar.
Vad är mer, reaktionsprocessen i Hsp90 är kopplad till en strukturell förändring i den enda aminosyran Arg380. Arg380 överför sedan strukturinformation till en underdomän av proteinet, och slutligen, överför det till proteinet som helhet. Den resulterande förändringen i struktur stänger ett centralt bindningsställe för proteinet, så att den kan uppfylla nya funktioner. University of Freiburg forskare misstänker att liknande hierarkiska mekanismer som den som demonstreras i Hsp90 -proteinet också är av grundläggande betydelse vid signalöverföring inom andra proteiner. Hugel säger att detta kan vara användbart för att använda läkemedel för att kontrollera proteiner.