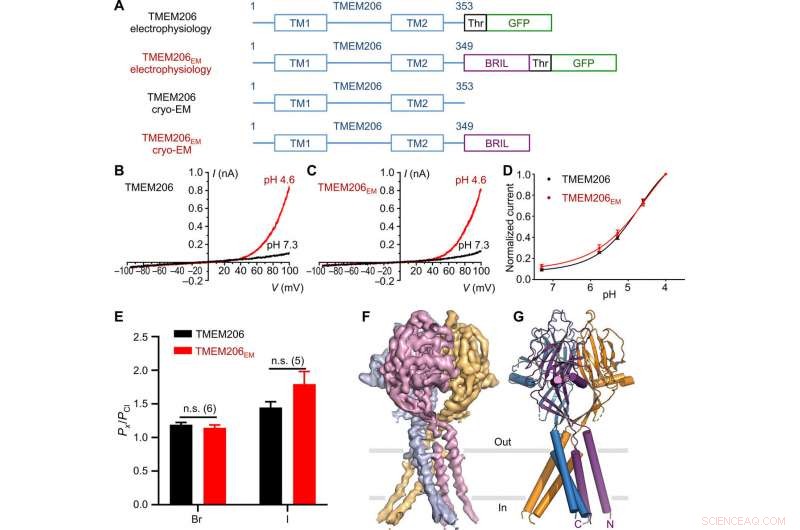
Funktion och struktur för pufferfish TMEM206. (A) Schematisk av kanalkonstruktioner som används för elektrofysiologi och kryo-EM-experiment med en enda partikel. "Thr" representerar ett trombin -klyvningsställe. (B och C) Representativa helcellsströmspår aktiverade av extracellulärt pH 4,6 för pufferfish TMEM206 (B) och TMEM206EM (C). Kanalkonstruktioner uttrycktes i TMEM206 knockout humana embryonala njure (HEK) 293T -celler. (D) Normaliserade ström-till-pH-förhållanden mellan pufferfish TMEM206 (n =6 till 9 celler per datapunkt) och TMEM206EM (n =5 till 6 celler per datapunkt). Alla strömmar registrerades vid rumstemperatur och normaliserades till pH 4,0 -strömmar vid +100 mV. (E) Anions selektivitet för pufferfish TMEM206 och TMEM206EM. Data presenteras som medel ± SEM (n.s., inte viktigt; Studentens test). (F) Cryo-EM-densitet för pufferfish TMEM206EM utformad vid 7,0 σ och färgad av individuella subenheter. (G) Trimerisk struktur av pufferfish TMEM206EM. Kreditera: Vetenskapliga framsteg , doi:10.1126/sciadv.abe5983
Transmembranproteinet 206 förkortat som TMEM206 är en evolutionärt bevarad kloridkanal som ligger till grund för det allestädes närvarande uttryckta, protonaktiverad, utåt korrigera anjonströmmar. I en ny rapport som nu publicerats den Vetenskapliga framsteg , Zengqin Deng och ett tvärvetenskapligt forskargrupp vid Washington University School of Medicine, i Saint Louis, USA beskrev cryo-elektronmikroskopi (cryo-EM) -strukturen för pufferfish TMEM206. Strukturen bildade en trimerisk kanal med två transmembransegment och en stor extracellulär domän. Enligt resultaten, Deng et al. visade hur en riklig vestibyl i den extracellulära regionen kunde nås i sidled från tre sidoportaler, där den centrala poren innehöll flera konstruktioner. Till exempel, en bevarad lysinrest nära den cytoplasmatiska regionen i den inre helixen, förmodligen bildat kloridjon -selektivitetsfiltret. Kärnstrukturen och sammansättningen liknade de hos natriumkanaler som inte är relaterade till aminosyrasekvensen, och därför utföra katjoner istället för anjoner. Tillsammans med elektrofysiologi gav de insikter om jonledning och gating för en ny klass av kloridkanaler som skiljer sig arkitektoniskt från tidigare beskrivna kloridkanalfamiljer.
Kloridjonkanaler
Kloridjoner är rikliga anjoner hos djur, och de rör sig över cellmembran via kloridkanaler och transportörer för en mängd olika cellulära funktioner, inklusive cellvolymreglering, intracellulär försurning och excitabilitetskontroll i muskler. Jonerna observeras i stor utsträckning i däggdjursceller även om molekylkomponenterna bakom kloridströmmarna har förblivit gäckande tills nu. Två oberoende studier som använde genomgående RNA-interferensscreening hade identifierat TMEM206 som den underliggande anjonkanalen. TMEM206 är evolutionärt bevarad hos ryggradsdjur. Kloridkanaler är olika i både aminosyrasekvens och tredimensionell arkitektur. I det här arbetet, Deng et al. presenterade en kryo-elektronmikroskopi (cryo-EM) struktur av pufferfish TMEM206 för att avslöja en trimerisk kanalarkitektur som skiljer sig från de som tidigare var kända. Forskarna kombinerade elektrofysiologi med detta arbete för att ge den första strukturella och funktionella beskrivningen av en evolutionärt bevarad och i stort uttryckt kloridkanal för att upprätta ett molekylärt ramverk och förstå kloridledning och kanalport.
Underenhetens struktur och kanalmontering. (A) Struktur för en enda underenhet, visar transmembrandomänen (röd), inre β-domän (blå), yttre β-domän (orange), och HTH (grön). Sekundära strukturelement anges. (B) Trimerisk kanalmontering. Två av underenheterna visas i ytrepresentation. (C) ortogonal vy som i (B), från den extracellulära sidan. Kreditera: Vetenskapliga framsteg , doi:10.1126/sciadv.abe5983 
Forskarna använde gröna fluorescerande proteinmärkta konstruktioner för att identifiera TMEM206-kandidater och valde pufferfish TMEM206 på grund av deras 50 procent delade sekvensidentitet med den mänskliga kloridkanalen. Deng et al. renade sedan full-längd vildtyp-pufferfish TMEM206-proteinet och utsatte det för enpartikel-kryo-EM-analys. Med hjälp av 3D -rekonstruktionskartor, de avslöjade en trimerisk kanalarkitektur med transmembrane och extramembrane domäner. TMEM206 bildade en symmetrisk trimer, där varje subenhet innehöll en transmembrandomän (TMD) med två membranspannande spiraler med namnet TM1 och TM2 och en stor extracellulär domän (ECD) berikad med β-domäner med ytterligare motiv som ytterligare organiserades i de övre och nedre skikten. Dessutom, omfattande sidokedjekontakter var inblandade genom van der Waals interaktioner i de inre och yttre β-domänerna. Den trimeriska kanalanordningen införde tre laterala öppningar eller sidoportaler i mitten av den extracellulära regionen för att sannolikt underlätta passage av jon och vatten. De långsträckta sidportalerna sträcker sig till ECD-TMD-övergången för att täta packningsinteraktioner ska återupptas. För att övervinna alla tekniska svårigheter att bestämma proteinets struktur, Deng et al. sammanfogade C-terminalen av benbegränsat interferoninducerat transmembranliknande protein (förkortat BRIL); ett fyra-helix-buntprotein som ofta används som en kristalliseringskaperon för att förbättra membranstabiliteten och främja kristallbildning.
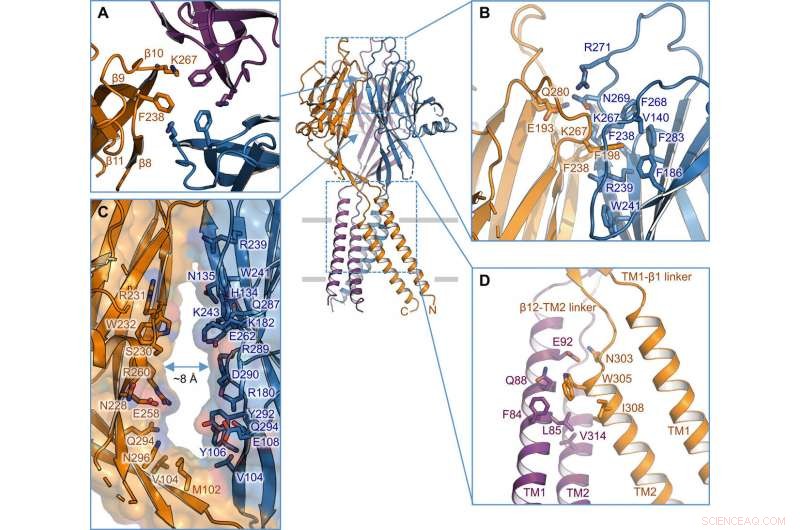
Intersubunit -gränssnitt. (A) Trimeriskt gränssnitt vid toppen av ECD. Sidokedjor av K267 och F238 är markerade. (B) sidovy av gränssnittet mellan enheter på det översta lagret av ECD. Rester som är involverade i gränssnittet visas i stickrepresentation. (C) Sidoportal i mitten av ECD mellan två angränsande subenheter. Yta och rester som kantar väggen illustreras. (D) TM1-TM2 gränssnitt mellan enheter. Kreditera: Vetenskapliga framsteg , doi:10.1126/sciadv.abe5983
Jonpermeationsvägar och mutagenesstudier
Med hjälp av porradieberäkningar, Deng et al. visade hur den centrala jonledningsporen innehöll flera sammandragningar för att förhindra jonpassage. Strukturen representerade icke-ledande konformation på grund av de höga pH-buffertförhållandena (pH 8,0) som användes för att bestämma cryo-EM-strukturen. Den voluminösa och avlånga centrala vestibulen kunde nås i sidled på grund av bristen på protein-proteinkontakter i den extracellulära domänen. Proteinkanalens smala punkt stör inte jonledningen och kan bibehållas under kanalgrindningscykeln när joner passerar genom de tre sidportalerna. Den något positiva elektrostatiska potentialen hos de inre väggarna i den centrala vestibulen och sidogångarna underlättade också attraktionen av kloridjoner. Vid den extracellulära domän-transmembrane domänen (ECD-TMD) tre strängar anslutna till de yttre spiralerna och rörde sig inåt för att ansluta inre spiraler för att generera en extracellulär grind ovanför bilipidskiktet. På varandra följande konstruktioner vid de porvända lägena bildade en hydrofob grind som skulle kunna förbjuda jonledning.
För att stödja de strukturella resultaten, Deng et al. utförde mutagenesstudier på viktiga porlevande rester. När de ersatte de konserverade basiska resterna med alanin eller sura rester, de syraaktiverade kloridströmmarna avskaffades. I kontrast, argininsubstitutioner behöll kanalfunktionen för att ytterligare stödja kravet på positiva laddningar i det anjon-selektiva filtret. Till exempel, I310 -domänen bildade en kritisk komponent i transmembranporten och en annan struktur känd som K320 bildade anjonselektivitetsfiltret. Arbetet stödde strukturell bevarande mellan mänskliga och pufferfish -ortologer för att representera en fysiologiskt relevant modell för kloridkanaler.
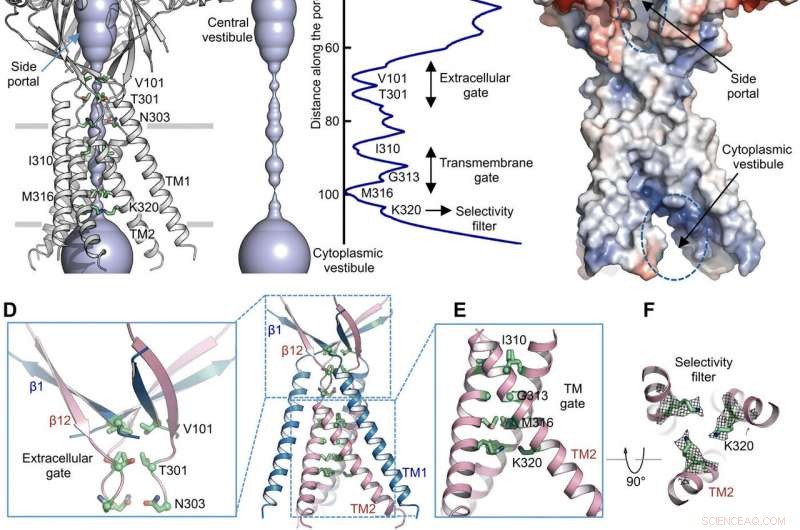
Jongenomträngningsväg. (A) Struktur för TMEM206EM och den centrala jonledningsporen, visas i ytrepresentation. Rester som genererar förträngningar markeras och märks. Sidoportalen anges. (B) Central jonledningspor och uppskattning av radien (höger panel). (C) Ytans representation av kanalen, färgad av ytelektrostatisk potential (röd, -5 kT/e; vit, neutral; blå, +5 kT/e). Sidoportalen och den cytoplasmatiska vestibulen anges. (D) extracellulär grind vid ECD-TMD-korsningen. V101, T301, och N303 visas i stickrepresentation. (E) Transmembranport, består av I310, G313, och M316. (F) Förmodat selektivitetsfilter definierat av K320. Dessutom visas sidkedjedensiteter för K320, konturerad vid 6,5 σ. (G och H) Strömtätheter med ett extracellulärt pH på 7,3 (G) och 4,6 (H) vid +100 mV för TMEM206 -mutanter. Helcellsmembranströmmarna registrerades genom att använda spänningsrampning från −100 till +100 mV i 500 ms vid en hållpotential på 0 mV. (I) Förhållande av strömtäthet vid pH 4,6 till pH 7,3. Kreditera: Vetenskapliga framsteg , doi:10.1126/sciadv.abe5983
Strukturell konvergens
Topologin, struktur och montering av TMEM206 representerade de i epitelnatriumkanalen (ENaC)/degenerinsuperfamiljen av jonkanaler, inklusive syrakänsliga jonkanaler (ASIC); trots brist på distinkt aminosyrasekvenshomologi mellan de två kanalerna. De trimeriska kanalerna för motsatt laddade natrium- och kloridjoner, delade ändå en gemensam kärnstruktur flankerad av två transmembranhelikrar. Teamet noterade hur den extracellulära porten mellan den centrala vestibulen och transmembranporen kunde expanderas till att passera joner efter kanalaktivering. Medan epitelnatriumkanaler kan aktiveras genom att frigöra hämmande peptider genom proteolys i den extracellulära domänen, ASIC och TMEM206 kunde endast aktiveras av extracellulära protoner. De bevarade strukturella särdragen mellan TMEM och AS1CS föreslog också analoga gating -konformationsförändringar för de två molekylerna.
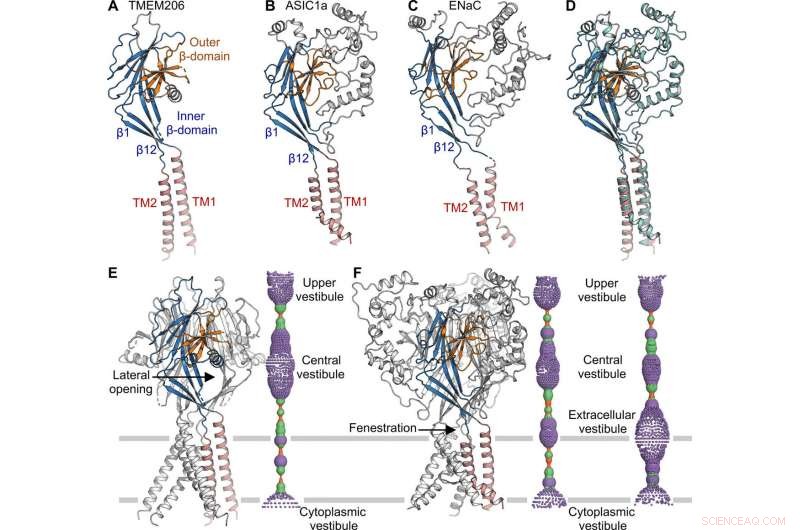
Strukturell jämförelse med ASIC och ENaC. (A till C) Underenhetstrukturer i TMEM206 (A), ASIC1a [Protein Data Bank (PDB):6AVE] (B), och ENaC (PDB:6BQN) (C). Domäner är på samma sätt färgade. (D) Superposition av TMEM206, färgad som i (A), och ASIC1a färgad i cyan. (E) Trimeric TMEM206 -kanal och dess centrala jonledningspor. Poren uppskattas med hjälp av programmet HOLE och avbildas som färgade prickar (porradie:röd <1,15 Å
Syn
På det här sättet, Zengqin Deng och kollegor använde kryo-EM med en partikel för att bestämma strukturen hos integrerade membranproteiner som vanligtvis är ouppnåeliga med traditionell röntgenkristallografi. Det är fortfarande en betydande teknisk utmaning att uppnå nära atomupplösning för membranproteiner av liten storlek på grund av låg kontrast och signal-brusförhållanden. Deng et al. erhöll en upplösningskonstruktion på 3,5 ångström för en kanal genom att smälta en liten kristalliseringskaperon BRIL för att förbättra stabiliteten hos de annars suboptimala membranproteinerna för att främja kristallpackning. Baserat på den bevarade kärnstrukturen, kanalerna var selektiva för antingen katjoner eller anjoner och upplevde liknande grindkonformationsförändringar. Arbetet etablerade en ny klass av kloridkanaler för att bilda en ny ram för ytterligare funktionella och mekaniska undersökningar inom cell- och strukturbiologi.
© 2021 Science X Network