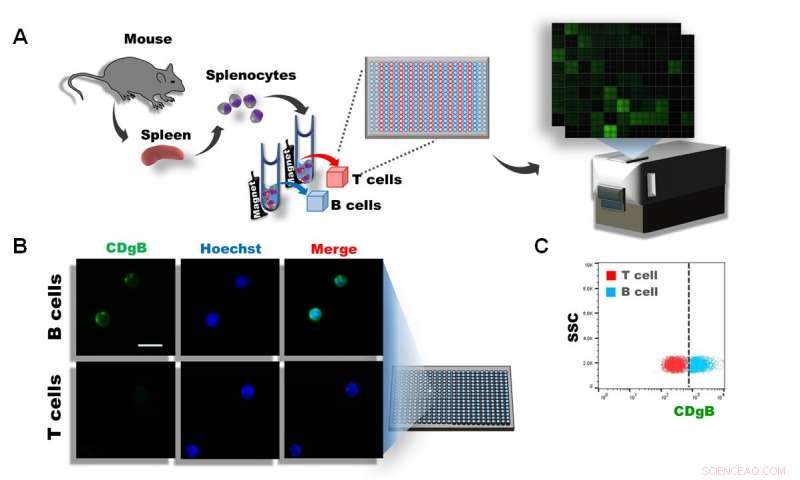
Figur 1. A) Splenocyter isolerades från musmjältar, och T- och B-celler separerades med hjälp av magnetisk aktiverad cellsortering (MACS). Cellerna ströks sedan ut i 384 brunnar och över 10, 000 olika fluorescerande molekyler screenades med användning av DOFLA. B) Fluorescensmikroskopbild visar att CDgB färgar B-celler men inte T-celler. C) Flödescytometrigraf över CDgB-fluorescens vs SSC mellan T-cells- och B-cellspopulationer. Kredit:Institute for Basic Science
Mänskligt blod innehåller flera olika komponenter, inklusive plasma, röda blodkroppar (RBC), vita blodkroppar (WBCs), och blodplättar. Bland dessa, WBC är indelade i många underkategorier, var och en med unika funktioner och egenskaper, såsom lymfocyter, monocyter, neutrofiler, och andra. Lymfocyter delas ytterligare in i T-lymfocyter, B-lymfocyter, och NK-celler. Att särskilja och separera olika typer av dessa celler är mycket viktigt för att genomföra studier inom området immunologi.
Att diskriminera olika immuncellstyper görs vanligtvis genom flödescytometri och fluorescensaktiverad cellsortering (FACS), som kan identifiera distinkta populationer av celler beroende på deras storlek, granularitet, och fluorescens. Även om storlek och granularitet enbart inte kan skilja celler med liknande fysiska parametrar, olika typer av immunceller uppvisar en distinkt kombination av immunreceptorer på cellytorna. Till exempel, T-lymfocyterna och B-lymfocyterna uttrycker CD3 och CD19, respektive. Därför, fluorescensidentifierande immunceller har förlitat sig på färgning av cellerna med hjälp av flera antikroppar mot olika receptorer. Man har länge trott att det var omöjligt att särskilja olika immuncellstyper utan att använda dessa antikroppar.
Dock, ny genombrottsforskning utförd av forskarna vid Center for Self-assembly and Complexity inom Institute for Basic Science, Sydkorea, kanske just har ändrat detta. Forskarna använde en mångfaldsorienterad fluorescensbiblioteksmetod (DOFLA) för att screena över 10, 000 olika fluorescerande molekyler med B- och T-lymfocyter separerade från musmjältar. Från detta, de lyckades upptäcka en ny fluorescerande sond som kan diskriminera B -lymfocyter över T -lymfocyter utan att cellreceptorn inriktar sig på antikroppar.
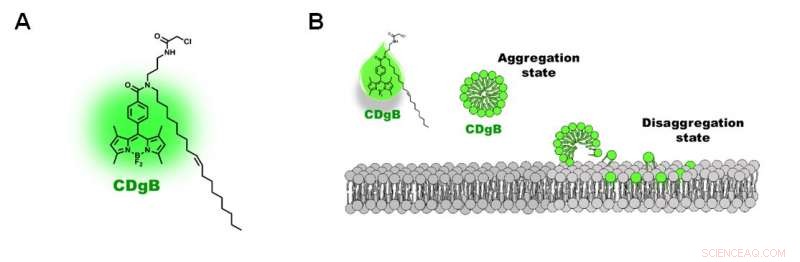
Figur 2. A) Struktur för CDgB-molekylen. B) Fri obunden CDgB bildar aggregat i lösning, som dissocierar när de binder till lipidmembran. Kredit:Institute for Basic Science
Forskarna kallade den nya sonden CDgB, som står för Compound of Designation grön för B-lymfocyter. CDgB är en lipofil molekyl som innehåller en fluorescerande komponent fäst till en kolvätekedja. Eftersom CDgB innehåller både en polär fluorescerande grupp och en kolvätesvans, det betyder att de fria obundna CDgB -färgmolekylerna bildar aggregat som liknar miceller i lösningen och uppvisar en låg nivå av bakgrundsfluorescens. När de fäster på cellytorna, dock, aggregaten dissocierar och orsakar en topp i fluorescenssignaler. Dessutom, färgämnets lipofila karaktär innebär att färgämnet inte binder till ett proteinmål, och lokaliserar istället direkt till lipidmembranstrukturen. Enligt forskarna, detta var "det första exemplet som rapporterade en sådan typ av cellsärskiljningsmekanism."
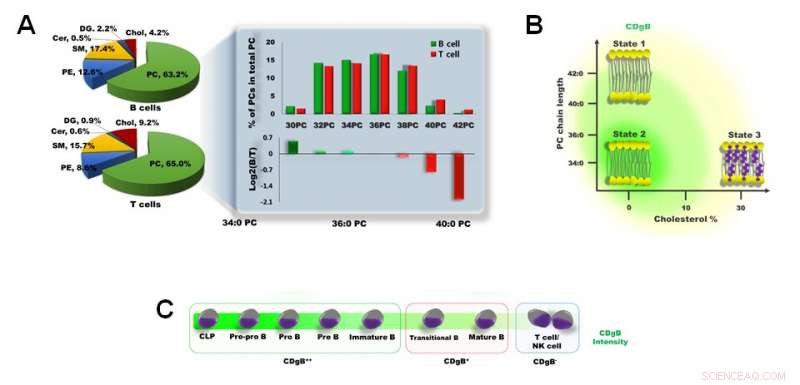
Figur 3. A) Skillnad i membranlipidsammansättning mellan B-celler och T-celler. B) CDgB färgar selektivt lipidmembran av B-celler som har kortare PC-kedjelängd och en lägre andel kolesterol. C) CDgB visar högre fluorescens i omogna B-celler (CDgB++) än i mogna B-celler (CDgB+) eller andra lymfocyter (CDgB-). Kredit:Institute for Basic Science
CDgB kan selektivt rikta in sig på cellmembranen hos B-lymfocyter över T-lymfocyter eller NK-celler. Forskarna försökte optimera selektiviteten för CDgB genom att testa olika derivat av molekylerna med olika kolvätekedjelängder från 4 till 20 kol. Det visade sig att CDgB-derivaten med 14 till 18 kolatomer visade den högsta selektiviteten mot B-lymfocyterna, med C18 som visar de bästa resultaten. Det blev svårare att särskilja cellerna genom fluorescens när kollängden ökades över 20. Det faktum att kollängden har betydelse för selektiviteten antydde att mekanismen var beroende av skillnaden i membranstrukturerna mellan B- och T-lymfocyter.
Forskarna klargjorde ytterligare denna mekanism genom att utföra lipidomanalys av B- och T-cellsmembran. Fosfatidylkolin (PC) utgör majoriteten (> 60 %) av membranfosfolipiderna i både B- och T-lymfocyter. Det visade sig att B-lymfocyter i allmänhet hade kortare PC än T-lymfocyternas. Dessutom, membrankolesterolhalten i T-lymfocyterna var ungefär två gånger högre än i B-lymfocyter. Dessa faktorer ger B -lymfocyterna ett mer '' flexibelt '' cellmembran, som ansågs vara en avgörande faktor som förklarar varför CDgB -molekylerna lättare fäster sig till cellmembranen i B -lymfocyterna över T -lymfocyternas. Även bland B-lymfocyterna, det visade sig att styrkan på fluorescensen var olika beroende på cellmognad. B-cellsprogenitorerna och omogna B-celler gav mycket ljusare fluorescenssignaler än mogna B-celler, vilket med största sannolikhet beror på den högre membranflexibiliteten i de omogna cellerna.
Forskarna drog vidare slutsatsen att denna nya lipidorienterade live cell distinction (LOLD) mekanism kan komplettera den befintliga cell distinktion mekanismen för att förbättra vår förmåga att särskilja specifika celltyper från komplicerade blandningar av olika celler. Denna forskning publicerades i Journal of the American Chemical Society .