Upphovsman:Wiley
Hämningen av patologiska protein -protein -interaktioner är ett lovande tillvägagångssätt för behandling av ett stort antal sjukdomar, inklusive många former av cancer. Ett team av forskare har nu utvecklat en bicyklisk peptid som binder till β-catenin-ett protein associerat med vissa typer av tumörer. Hemligheten för deras framgång är den cykliska naturen och hårnålsformen hos peptiden, som efterliknar en naturlig proteinstruktur, de rapporterar i tidningen Angewandte Chemie .
På grund av de omfattande proteinregionerna som är involverade i protein -protein -interaktioner, terapeutiska tillvägagångssätt som involverar små molekyler är ofta misslyckade. Proteinmimetik är alternativ som imiterar den rumsliga strukturen hos bindningssegment av naturliga proteinbindande partner. Även om β-ark-proteinstrukturer gjorda av flera utsträckta peptidkedjor arrangerade sida vid sida, som liknar ett pappersark vikt som ett dragspel - spelar ofta en roll i interaktionen mellan proteiner, de har sällan använts som grund för efterlikning. Detta beror delvis på att de har problem med att komma in i målcellen, och sålunda, kan inte nå det patogena proteinet.
Under ledning av Tom N. Grossmann, ett internationellt team från Vrije Universiteit Amsterdam (Nederländerna), Università degli Studi di Napoli "Federico II" (Italien), samt AstraZeneca (Cambridge, STORBRITANNIEN), har nu rapporterat utformningen av β-arkmimetika som hämmar det intracellulära onkogena proteinet β-catenin. β-Catenin är en komponent i Wnt-signalvägen och aktiverar T-cellfaktorer (TCF), som i slutändan stimulerar celltillväxt och proliferation. Hyperaktivering av Wnt -vägen är associerad med olika former av cancer. Hämning av interaktionen mellan β-catenin och TCF är således ett tilltalande terapeutiskt tillvägagångssätt.
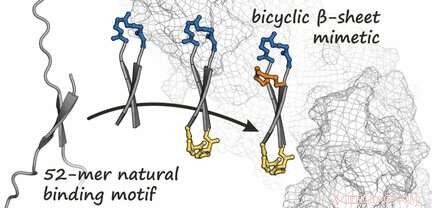
Baserat på den kända strukturen för β-catenin när den är i ett komplex med ett protein, laget producerade först en bindande partner för β-catenin. Denna partner är en ringformad peptid som bildar en kort, antiparallellt β-ark-känt som en β-hårnålsstruktur-när det är bundet till β-katenin, vilket framgår av en analys av dess kristallstruktur. Tanken var att fixa denna cykliska peptid i hårnålsformen genom att införa en ytterligare brygga. Detta genererar en bicyklisk struktur som stärker bindningen till β-katenin. Genom att använda en serie olika syntetiserade varianter, laget kunde identifiera flera bicykliska peptider med hög affinitet för β-catenin. Bland dessa, de hittade en förening som (förutom den ursprungliga cykliska peptiden) framgångsrikt penetrerar celler och signifikant hämmar den onkogena Wnt -signalkaskaden.
Detta nyutvecklade bicykliska β-arkmimetik representerar således en möjlig utgångspunkt för utvecklingen av nya antitumörläkemedel som hämmar cellulär Wnt-signalering. Denna strategi kan också användas för design av ytterligare hämmare av andra protein-protein-interaktioner medierade av β-ark.