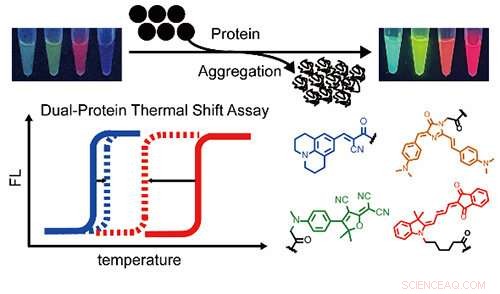
En serie sensorer för proteinaggregation i flera färger och en termisk skiftanalys med två färger för att rapportera om proteinsamaggregation av två olika proteiner samtidigt och kvantitativt. Kredit:BAI Yulong
Samaggregation av flera patogena proteiner är vanligt vid neurodegenerativa sjukdomar. Dock, dekonvolutionen av en sådan biokemisk process är fortfarande utmanande.
Nyligen, en forskargrupp ledd av Prof. Liu Yu från Dalian Institute of Chemical Physics (DICP) vid den kinesiska vetenskapsakademin utvecklade en tvåfärgad fluorogenisk termisk skiftanalys för att samtidigt demonstrera aggregationen av två olika proteiner och kvantitativt studera deras termodynamiska stabilitet under samaggregation.
Denna studie publicerades i Kemivetenskap .
Forskarna utvecklade flerfärgssensorer för fluorogena proteinaggregation för att utöka spektraltäckningen. Sedan kvantifierade de förändringar i smälttemperaturer i ett heterozygot modellproteinsystem, vilket avslöjade att den termodynamiska stabiliteten hos vildtypsproteiner var signifikant äventyras av de mutanta men inte vice versa.
De undersökte också hur små molekylligander selektivt och differentiellt störde ett sådant samspel.
"Dessa sensorer är lämpade för att visualisera hur olika proteiner utövar inflytande på varandra vid deras samaggregation i levande celler, " sa Prof. Liu.
Särskilt, de undersökte hur amyloidogena transtyretinproteiner interagerade med apolipoprotein IV-proteiner under deras samaggregationsprocess, vilket indikerade att apolipoprotein IV var en farmakologisk chaperon.