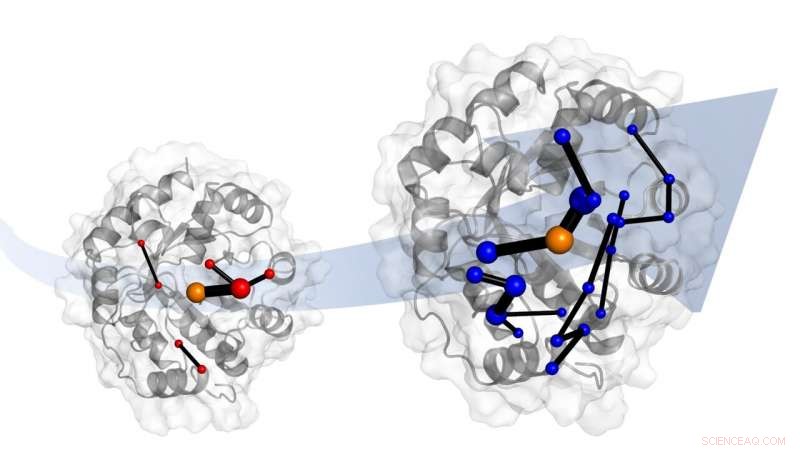
Laboratorieutveckling av ett designenzym gör det till en mycket bättre katalysator. Simuleringar visar att evolutionen gör detta genom att introducera nätverk av aminosyror. Dessa nätverk lovar att vara mallar för katalysatordesign. Kredit:Dr Adrian Bunzel
Forskare vid University of Bristol har visat hur laboratorieutveckling kan ge upphov till högeffektiva enzymer för naturliga reaktioner, öppnar dörren för nya och mer miljövänliga sätt att tillverka droger och andra kemikalier.
Forskare har tidigare designat proteinkatalysatorer från grunden med hjälp av datorer, men dessa är mycket mindre kapabla än naturliga enzymer. För att förbättra sina prestationer, en teknik som kallas laboratorieutveckling kan användas, som den amerikanska kemiingenjören Frances Arnold var pionjär för och som hon fick Nobelpriset för 2018. Riktad evolution imiterar naturligt urval, tillåta forskare att använda biologins kraft för att förbättra proteiners förmåga att utföra uppgifter som att katalysera en specifik kemisk reaktion.
Men även om forskargruppen nyligen hade använt laboratorieutveckling för att förbättra ett designat enzym med mer än 1, 000 gånger, det var okänt hur evolutionen ökar sin aktivitet. Tills nu.
Huvudförfattaren professor Adrian Mulholland från Bristol's School of Chemistry sa:"Evolution kan göra katalysatorer mycket mer aktiva. Saken är den, evolutionen fungerar på mystiska sätt:t.ex. mutationer som uppenbarligen förbättrar katalys involverar ofta förändringar i aminosyror långt från det aktiva stället där reaktionen sker."
"Vi ville förstå hur evolutionen kan omvandla ineffektiva designerbiokatalysatorer till högaktiva enzymer." studiens första författare, Dr Adrian Bunzel, sa.
Att göra så, det internationella forskarteamet från Bristol, ETH Zürich och University of Waikato (NZ) vände sig till molekylära datorsimuleringar. "Dessa visar att evolutionen förändrar hur proteinet rör sig - dess dynamik. Enkelt uttryckt, evolutionen "stämmer" flexibiliteten hos hela proteinet, " han lade till.
Teamet identifierade också nätverket av aminosyror i proteinet som är ansvarigt för denna "justering". Dessa nätverk involverar delar av proteinet som förändras av evolutionen.
Dr. Bunzel sa:"Efter evolutionen, hela proteinet verkar samverka för att påskynda reaktionen. Detta är viktigt eftersom när vi designar enzymer, vi fokuserar ofta bara på den aktiva webbplatsen, och glöm resten av proteinet."
Prof Mulholland tillade:"Denna sorts analys kan hjälpa till att designa mer effektiva 'de novo' enzymer, för reaktioner som vi tidigare inte kunde rikta in oss på."
Forskningen, publiceras i Naturkemi , avslöjar hur evolutionen gör designenzymer kraftfullare, banar väg för skräddarsydda katalysatorer för grön kemi.
Forskarna kommer nu att använda sina resultat för att hjälpa till att designa nya proteinkatalysatorer.